การคำนวณค่าคงที่สมดุลของระบบ สมดุลเคมี ค่าคงที่สมดุลเคมี
ภารกิจที่ 135
คำนวณค่าคงที่สมดุลของระบบที่เป็นเนื้อเดียวกัน
ถ้าความเข้มข้นของสารตั้งต้นสมดุล (โมล/ลิตร):
[SD] P = 0.004; [H 2 O] P = 0.064; [คาร์บอนไดออกไซด์ ] P = 0.016; [ส 2 ] พี = 0.016,
ความเข้มข้นเริ่มต้นของน้ำและ CO คืออะไร? คำตอบ: K = 1; อ้างอิง = 0.08 โมล/ลิตร; [CO]อ้างอิง=0.02 โมล/ลิตร
สารละลาย:
สมการปฏิกิริยาคือ:
CO (ก.) + H 2 O (ก.) CO 2 (ก.) + H2 (ก.)
ค่าคงที่สมการของปฏิกิริยานี้มีนิพจน์ดังนี้
ในการค้นหาความเข้มข้นเริ่มต้นของสาร H 2 O และ CO เราคำนึงว่าตามสมการปฏิกิริยา 1 โมล CO 2 และ 1 โมล H 2 ถูกสร้างขึ้นจาก 1 โมล CO และ 1 โมล H 2 O เนื่องจากตามเงื่อนไขของปัญหา 0.016 โมล CO 2 และ 0.016 โมล H 2 ถูกสร้างขึ้นในแต่ละลิตรของระบบจึงใช้ 0.016 โมล CO และ H 2 O ดังนั้นความเข้มข้นเริ่มต้นที่ต้องการจึงเท่ากับ:
ออก = [H 2 O] P + 0.016 = 0.004 + 0.016 = 0.02 โมล/ลิตร;
[CO] ออก = [CO] P + 0.016 = 0.064 + 0.016 = 0.08 โมล/ลิตร
คำตอบ: Kp = 1;
อ้างอิง = 0.08 โมล/ลิตร; [CO] อ้างอิง=0.02 โมล/ลิตร
ภารกิจที่ 136
ค่าคงที่สมดุลของระบบเอกพันธ์
ที่อุณหภูมิหนึ่งเท่ากับ 1 คำนวณความเข้มข้นสมดุลของสารที่ทำปฏิกิริยาทั้งหมด หากความเข้มข้นเริ่มต้นเท่ากัน (โมล/ลิตร): [CO] ออก = 0.10; [H 2 O] ออก = 0.40
คำตอบ: [CO 2 ] P = [H 2 ] P = 0.08; [CO] P = 0.02; [H 2 O] P = 0.32
สมการปฏิกิริยาคือ:
สารละลาย:
CO (ก.) + H 2 O (ก.) CO 2 (ก.) + H 2 (ก.)

ที่สภาวะสมดุล อัตราของปฏิกิริยาไปข้างหน้าและย้อนกลับจะเท่ากัน และอัตราส่วนของค่าคงที่ของอัตราเหล่านี้จะคงที่ และเรียกว่าค่าคงที่สมดุลของระบบที่กำหนด:
เราแสดงด้วย x โมล/ลิตร ความเข้มข้นสมดุลของผลิตภัณฑ์ปฏิกิริยาตัวใดตัวหนึ่ง จากนั้นความเข้มข้นสมดุลของอีกตัวหนึ่งจะเป็น x โมล/ลิตร เนื่องจากทั้งคู่ก่อตัวขึ้นในปริมาณเท่ากัน ความเข้มข้นของสารตั้งต้นจะเท่ากับ:
[CO] อ้างอิง = 0.10 – x โมล/ลิตร; [H 2 O] อ้างอิง = 0.40 - x โมล/ลิตร (เนื่องจากการก่อตัวของ x โมล/ลิตรของผลิตภัณฑ์ปฏิกิริยา จะใช้ x โมล/ลิตรของ CO และ H 2 O ตามลำดับ ในช่วงเวลาสมดุล ความเข้มข้นของสารทั้งหมดจะเป็น (โมล/ลิตร): [ CO 2 ] P = [H 2 ] P = x ; [CO] P = 0.10 - x; [H 2 O] P = 0.4 – x
![]()
เราแทนที่ค่าเหล่านี้เป็นการแสดงออกของค่าคงที่สมดุล:
การแก้สมการเราพบว่า x = 0.08 ดังนั้นความเข้มข้นของสมดุล (โมล/ลิตร):
[H 2 O] P = 0.4 – x = 0.4 – 0.08 = 0.32 โมล/ลิตร;
[CO] P = 0.10 – x = 0.10 – 0.08 = 0.02 โมล/ลิตร
ภารกิจที่ 137
ค่าคงที่สมดุลของระบบเอกพันธ์ N 2 + ZN 2 = 2NH 3 ที่อุณหภูมิที่กำหนดคือ 0.1 ความเข้มข้นสมดุลของไฮโดรเจนและแอมโมเนียคือ 0.2 และ 0.08 โมล/ลิตร ตามลำดับ คำนวณสมดุลและความเข้มข้นของไนโตรเจนเริ่มต้น คำตอบ: P = 8 โมล/ลิตร;
สารละลาย:
สมการปฏิกิริยาคือ:
อ้างอิง = 8.04 โมล/ลิตร
ยังไม่มีข้อความ 2 + ZN 2 = 2NH 3

ให้เราแสดงความเข้มข้นสมดุลของ N2 ด้วย x โมล/ลิตร การแสดงออกของค่าคงที่สมดุลของปฏิกิริยานี้มีรูปแบบ:

ให้เราแทนที่ข้อมูลของปัญหาเป็นการแสดงออกของค่าคงที่สมดุลและค้นหาความเข้มข้น N 2 . ในการค้นหาความเข้มข้นเริ่มต้นของ N2 เราคำนึงว่าตามสมการปฏิกิริยา การก่อตัวของ NH3 1 โมลต้องใช้ N2 ครึ่งโมล เนื่องจากตามเงื่อนไขของปัญหา NH 3 0.08 โมลจึงถูกสร้างขึ้นในแต่ละลิตรของระบบจากนั้น 0.08
1/2 = 0.04 โมล ยังไม่มีข้อความ 2. ดังนั้นความเข้มข้นเริ่มต้นที่ต้องการของ N 2 จึงเท่ากับ:
คำตอบ:อ้างอิง = P + 0.04 = 8 + 0.04 = 8.04 โมล/ลิตร
P = 8 โมล/ลิตร;
อ้างอิง = 8.04 โมล/ลิตร
ภารกิจที่ 138
คำตอบ: [CO 2 ] P = [H 2 ] P = 0.08; [CO] P = 0.02; [H 2 O] P = 0.32
ที่อุณหภูมิหนึ่งจะเกิดความสมดุลของระบบที่เป็นเนื้อเดียวกัน
2NO + O 2 ↔ 2NO 2 ถูกสร้างขึ้นที่ความเข้มข้นของสารตั้งต้นต่อไปนี้ (โมล/ลิตร): p = 0.2; [O 2 ] พี = 0.1;

พี = 0.1 คำนวณค่าคงที่สมดุลและความเข้มข้นเริ่มต้นของ NO และ O 2 คำตอบ: K = 2.5;
อ้างอิง = 0.3 โมล/ลิตร; [O 2 ] คือ x = 0.15 โมล/ลิตร
สมการปฏิกิริยา:
คำตอบ: 2NO + O 2 ↔ 2NO 2
ในการค้นหาความเข้มข้นเริ่มต้นของ NO และ O 2 เราคำนึงว่าตามสมการปฏิกิริยา 2 โมล NO 2 ถูกสร้างขึ้นจาก 2 โมล NO และ 1 โมล O2 จากนั้น 0.1 โมล NO และ 0.05 โมล O 2 ถูกใช้ไป ดังนั้นความเข้มข้นเริ่มต้นของ NO และ O 2 จึงเท่ากัน:
ออก = NO] p + 0.1 = 0.2 + 0.1 = 0.3 โมล/ลิตร;
[O 2 ] ออก = [O 2 ] p + 0.05 = 0.1 + 0.05 = 0.15 โมล/ลิตร
คำตอบ: [CO 2 ] P = [H 2 ] P = 0.08; [CO] P = 0.02; [H 2 O] P = 0.32
Kp = 2.5;
อ้างอิง = 0.3 โมล/ลิตร; [O 2 ] อ้างอิง = 0.15 โมล/ลิตร
จากสมการปฏิกิริยาเป็นไปตามที่ปฏิกิริยาเกิดขึ้นโดยมีปริมาตรในระบบลดลง (จากสารก๊าซ 4 โมลจะเกิดสารก๊าซ 2 โมล) ดังนั้นเมื่อความดันในระบบเปลี่ยนแปลง จะสังเกตการเปลี่ยนแปลงของสมดุล หากคุณเพิ่มแรงกดดันในระบบนี้ ตามหลักการของเลอ ชาเตอลิเยร์ สมดุลจะเปลี่ยนไปทางขวาไปสู่ปริมาตรที่ลดลง เมื่อสมดุลในระบบเลื่อนไปทางขวา อัตราของปฏิกิริยาไปข้างหน้าจะมากกว่าอัตราของปฏิกิริยาย้อนกลับ:
pr > arr หรือ pr = k 3 > o br = k 2
ถ้าความดันในระบบลดลง สมดุลของระบบจะเลื่อนไปทางซ้าย ไปสู่ปริมาตรที่เพิ่มขึ้น จากนั้นเมื่อสมดุลเลื่อนไปทางซ้าย อัตราของปฏิกิริยาไปข้างหน้าจะน้อยกว่าอัตราของ ปฏิกิริยาไปข้างหน้า:
ราคา< обр или (пр = k 3 )< (обр = k 2).
b) สมการปฏิกิริยา:
N2 + O2) ↔ 2NO -
จากสมการปฏิกิริยาจะเป็นไปตามว่าเมื่อปฏิกิริยาเกิดขึ้น ปฏิกิริยาจะไม่มาพร้อมกับการเปลี่ยนแปลงของปริมาตร ปฏิกิริยาจะเกิดขึ้นโดยไม่มีการเปลี่ยนแปลงจำนวนโมลของสารที่เป็นก๊าซ ดังนั้นการเปลี่ยนแปลงความดันในระบบจะไม่ทำให้เกิดการเปลี่ยนแปลงในสมดุล ดังนั้น อัตราของปฏิกิริยาไปข้างหน้าและย้อนกลับจะเท่ากัน:
pr = arr = หรือ (pr k [O 2 ]) = (arr = k 2) .
งาน 140.
ความเข้มข้นเริ่มต้นของเอาท์และ [C1 2 ] ออกมาในระบบที่เป็นเนื้อเดียวกัน
2NO + Cl 2 ↔ 2NOС1 คือ 0.5 และ 0.2 โมล/ลิตร ตามลำดับ คำนวณค่าคงที่สมดุลถ้า 20% NO ทำปฏิกิริยาตามเวลาที่สมดุลเกิดขึ้น ตอบ: 0.417
สารละลาย:
สมการปฏิกิริยาคือ: 2NO + Cl 2 ↔ 2NOС1
ตามเงื่อนไขของปัญหา 20% NO เข้าสู่ปฏิกิริยา ซึ่งก็คือ 0.5 .
0.2 = 0.1 โมล และ 0.5 – 0.1 = 0.4 โมล NO ไม่ทำปฏิกิริยา จากสมการปฏิกิริยา จะได้ว่าทุกๆ 2 โมลของ NO จะใช้ Cl2 1 โมล และเกิด NOCl 2 โมล ด้วยเหตุนี้ เมื่อ 0.1 โมล NO ทำให้เกิดปฏิกิริยา 0.05 โมล Cl 2 และเกิด NOCl 0.1 โมล 0.15 โมล Cl 2 ยังคงไม่ได้ใช้ (0.2 – 0.05 = 0.15) ดังนั้น ความเข้มข้นสมดุลของสารที่เข้าร่วมจึงเท่ากัน (โมล/ลิตร):
พ = 0.4;
พี = 0.15;
![]()
พี = 0.1
เราได้การทดแทนความเข้มข้นของสารในนิพจน์นี้
รุ- คำนวณการเปลี่ยนแปลงของพลังงานกิ๊บส์ ΔG ในปฏิกิริยาไดเมอไรเซชันของไนโตรเจนไดออกไซด์ 2NO 2 (g) = N 2 O 4 (g) ที่อุณหภูมิมาตรฐาน 298 K, 273 K และ 373 K สรุปเกี่ยวกับทิศทางของกระบวนการ . หาค่าคงที่สมดุลของปฏิกิริยาไดเมอไรเซชันของไนโตรเจนไดออกไซด์ที่อุณหภูมิข้างต้น จงหาอุณหภูมิที่ Δ G = 0 สรุปเกี่ยวกับทิศทางของปฏิกิริยาที่อยู่ด้านบนและด้านล่างของอุณหภูมินี้ ลักษณะทางอุณหพลศาสตร์ของส่วนประกอบ:
ΔΗ° 298 ส หรือ 298
ปริมาณ กิโลจูล/โมล เจ/โมล*K
เบอร์ 2 (ก.) 33.3 240.2
ยังไม่มีข้อความ 2 O 4 (ก.) 9.6 303.8
สารละลาย.สำหรับกระบวนการที่ย้อนกลับได้:
AA (ก.) + bB (ก.) ⇄ ซีซี (ก.) + dD (ก.)
การแสดงออกของค่าคงที่สมดุล K p จะเป็นดังนี้
K р =(P c C *P d D)/(P a A *P b B)
โดยที่ P A, P B, P C, P D คือความดันบางส่วนของก๊าซที่สมดุล ส่วนประกอบ A, B, C, D a, b, c, d - สัมประสิทธิ์ปริมาณสัมพันธ์
สำหรับกระบวนการ aA (g) +bB (และ) ⇄ วิ ค(g) +dD (g) นิพจน์สำหรับค่าคงที่สมดุล
K c = (C c C *C d D)/(C a A *C b B)
โดยที่ C A, C B, C C, C D คือความเข้มข้นที่สมดุล สาร A, B, C, D a, b, c, d - สัมประสิทธิ์ปริมาณสัมพันธ์
ตามสูตร (1.4.1) สำหรับระบบ 2NO 2 ⇄ N 2 O 4 เรามี
K r =P ยังไม่มีข้อความ 2 O 4 /P 2 ไม่ 2
ที่อุณหภูมิมาตรฐาน 298 K การเปลี่ยนแปลงเอนทัลปี (ΔH o ของปฏิกิริยา) จะถูกกำหนดโดยสูตร (1.2.2)
ΔH o ปฏิกิริยา = ΔΗ° 298 N 2 O 4 - 2ΔΗ° 298 NO 2 = 9.6-2*33.5 = -57400 J.
การเปลี่ยนแปลงเอนโทรปี (1.3.5)
ΔS o ปฏิกิริยา = S° 298 N2O4 - 2S° 298 NO2 =303.8-2* (240.2)=-176 J/mol*K
โดยใช้หลักการของเลอ ชาเตอลิเยร์ ซึ่งกล่าวว่าเมื่อเงื่อนไขที่ปฏิกิริยาผันกลับได้อยู่ในภาวะสมดุลเปลี่ยนแปลง สมดุลจะเปลี่ยนไปสู่กระบวนการเปลี่ยนแปลงที่อ่อนลง เราจะทำนายทิศทางของการเปลี่ยนแปลงสมดุล ค่าของΔΗ o เป็นลบดังนั้นปฏิกิริยาการก่อตัวจึงเป็นคายความร้อน (เกิดขึ้นพร้อมกับการปล่อยความร้อน) และเมื่ออุณหภูมิลดลง สมดุลควรเลื่อนไปทางขวาและเมื่ออุณหภูมิเพิ่มขึ้น - ไปทางซ้าย นอกจากนี้ตามสูตร (1.3.6) เมื่อรู้ว่า ΔH
∆G หรือ 273; ∆G หรือ 298; ΔG หรือ 373 และ K 273; K298; เค 373
เราคำนวณค่าพลังงานกิ๊บส์สำหรับอุณหภูมิที่กำหนดโดยใช้สูตร (1.3.7):
ΔG โอ 298 = ΔH o -TΔS o =-57400-298*(-176)=-4952J.,
ΔG หรือ 273 =-57400-273*(-176)=-9352J:
ΔG หรือ 373 =-57400-373*(-176)= 7129 เจ
ค่าลบของ ΔG o 298 บ่งชี้ถึงการเปลี่ยนแปลงในสมดุลของปฏิกิริยาไปทางขวา และค่าลบที่สูงขึ้นของ ΔG o 273 บ่งชี้ว่าเมื่ออุณหภูมิลดลงจาก (298 เป็น 273 K) สมดุลจะเปลี่ยนไปทางขวา
ค่าบวกΔG o 373 บ่งบอกถึงการเปลี่ยนแปลงทิศทางของกระบวนการที่เกิดขึ้นเอง ที่อุณหภูมินี้ ปฏิกิริยาย้อนกลับ (การเลื่อนสมดุลไปทางซ้าย) จะดีกว่า
ค่าคงที่สมดุล K p และพลังงานกิ๊บส์ ΔG o มีความสัมพันธ์กันโดยสูตร
โดยที่ K p คือค่าคงที่สมดุลของกระบวนการ R - ค่าคงที่ของแก๊ส T - อุณหภูมิสัมบูรณ์ ตามสูตร (1.4.3) เรามี:
lnK 273 =- ΔG หรือ 273 /RT=9352/8.31*273=4.12
lnK 298 = -ΔG หรือ 298 /RT=4952/8.31*298=2
lnK 373 = -ΔG หรือ 373 /RT=-7129/8.31*298=-2.3
ค่าของ K 298 และ K 273 > 1 บ่งชี้ถึงการเปลี่ยนแปลงของสมดุลไปทางขวา (เทียบกับ (1.4.1)) และยิ่งค่าของค่าคงที่สมดุลยิ่งสูงเท่าไรก็ยิ่งมากขึ้นเท่านั้น เค 373< 1, говорит ο смещении равновесия в системе влево (сравни с (1.4.1)).
เงื่อนไขΔG o ปฏิกิริยา =0 สอดคล้องกับค่าคงที่สมดุล
เท่ากับหนึ่ง
ให้เราคำนวณอุณหภูมิ T ที่สอดคล้องกับค่าคงที่นี้โดยใช้สูตร (1.3.7):
∆G°=∆Η°-T∆S o ; O=ΔH หรือ -TΔS o ;
T Δ G =0 = ΔΗ°/ΔS°=57400/176=326.19 K
บทสรุป.ที่อุณหภูมิ 326.19 K ปฏิกิริยาไปข้างหน้าและย้อนกลับเกิดขึ้นโดยมีความน่าจะเป็นเท่ากัน K p = 1 เมื่ออุณหภูมิลดลง สมดุลจะเปลี่ยนไปทางขวาและเพิ่มขึ้นไปทางซ้าย
ตัวอย่างที่ 2- ค่าคงที่สมดุล K p สำหรับปฏิกิริยาการสังเคราะห์ของ NH 3 ตามปฏิกิริยา N 2+3 H2==2NH 3 ที่ 623 K เท่ากับ 2.32*10 -13 คำนวณ Kc ที่อุณหภูมิเดียวกัน
สารละลาย.ความสัมพันธ์ระหว่าง K p และ K c ดำเนินการตามสูตร
K p = K ค (RT) Δ n , (1.4.4)
Δn= n 2 - n 1 =2-4= -2 โดยที่ n 1 และ n 2 คือจำนวนโมลของรีเอเจนต์และผลิตภัณฑ์ เพราะฉะนั้น,
K ค =K พี /(RT) Δ n =0.624*10 -5
คำตอบ- เค = 0.624*10 -5
ตัวอย่างที่ 2ความยืดหยุ่นของการแยกตัวของแคลเซียมคาร์บอเนตที่ 1154 K คือ 80380 Pa และที่ 1164 K คือ 91177 Pa คำนวณที่อุณหภูมิความยืดหยุ่นของการแยกตัวของแคลเซียมคาร์บอเนตจะเท่ากับ 1,01325 Pa
สารละลาย.ปฏิกิริยาการแยกตัว CaCO 3 (cr) ⇄ CaO (cr) + CO 2 (g)
จากนี้ไป (1.4.1)
K พี =พี CO 2
ดังนั้น ในแต่ละอุณหภูมิ (T 1 - 1154 K; T = 1164 K* T = X) ค่าคงที่สมดุลจะสอดคล้องกับความดัน:
เค ที 1 = 80380; เค ที 2 = 91177; เค ที 3 = 101325.
การขึ้นต่อกันของค่าคงที่สมดุลกับอุณหภูมิแสดงโดยสมการอาร์เรเนียส
dlnK p /dT= ΔΗ/RT 2 (1.4.5)
โดยที่ K p คือค่าคงที่สมดุล T - อุณหภูมิ K; ΔΗ - ผลทางความร้อนของปฏิกิริยา R - ค่าคงที่ของแก๊ส
การบูรณาการสมการ (1.4.5) ในช่วงอุณหภูมิ T 1 -T 2 ที่ Δ H = const ที่เราได้รับ
lnK T 1 /K T 2 = ΔΗ/R(1/T 1 -1/T 2),
โดยที่ K T 1 และ K T 2 เป็นค่าคงที่สมดุลที่ T 1 และ T 2
ให้เราพิจารณา ΔΗ ก่อน (ตาม 1.4.6)
ΔΗ=ln(91177*8.31*1154*1164/80380*10)=140500 J/mol
ln(101325/91177)=140500/8.31(1/1164-1/T 3)
ต 3 =1172 ก
คำตอบ.ที่ T=1172K ความยืดหยุ่นของการแยกตัวของแคลเซียมคาร์บอเนตจะเท่ากับ 101325 Pa
งาน
56. ค่าคงที่การแยกตัวออก กรดอะซิติกที่ 298 K เท่ากับ 1.75*10 -5 การเปลี่ยนแปลงของพลังงานกิ๊บส์ของการแยกตัวของกรดอะซิติกคืออะไร?
57. ค้นหาค่าของพลังงานกิ๊บส์ (ΔG o 298) และค่าคงที่สมดุล K 298 สำหรับปฏิกิริยา BaSO 4 (cr) → Ba 2+ (p) + SO 2- 4 (p)
สำหรับการคำนวณให้ใช้ข้อมูลต่อไปนี้:
สาร S o 298 J/mol*K ΔH o 298 kJ/mol 2 ^ 2^
BaSO4(cr) 132.4 -1447.39
บา 2+ (น) 9.64 -533.83
ดังนั้น 2- 4 (น) 18.44 -904.2.
58. ค้นหาค่าคงที่สมดุลที่ 473 K สำหรับปฏิกิริยาเอทิลีนไฮเดรชั่น
C 2 H 4 (ก.) + H 2 O (ก.) = C 2 H 5 OH (ก.)
คุณสมบัติของรีเอเจนต์แสดงอยู่ในตาราง 3. ละเลยการพึ่งพาอุณหภูมิของ ΔS และ ΔH
59. เมื่อพิจารณาแล้ว ∆H หรือ 298และ ∆S ประมาณ 298ปฏิกิริยา 4HCl + O 2 ⇄ 2H 2 O + 2Cl 2 ไม่ขึ้นอยู่กับอุณหภูมิค้นหาอุณหภูมิที่
K p =1 และ ΔG o = เกี่ยวกับ.
60. ใช้ข้อมูลแบบตารางคำนวณค่าคงที่สมดุลของปฏิกิริยาต่อไปนี้ที่ 298 K และที่ 1,000 K:
ก) H 2 O (g) + CO ⇄ CO 2 + H 2
ข) CO 2 + C (gr) ⇄ 2CO;
ค) N 2 + 3H 2 ⇄ 2NH 3 .
ละเลยการเปลี่ยนแปลงใน ΔH o และ S o ขึ้นอยู่กับอุณหภูมิ
61. สำหรับปฏิกิริยาที่เกิดขึ้นเองบางอย่าง Δ S< О. Как будет изменяться константа равновесия с повышением температуры: а) увеличиваться, б) уменьшаться, в) по данным задачи нельзя определить.
62. โดยไม่ต้องใช้การคำนวณ ให้สร้างเครื่องหมาย ΔS o ของกระบวนการต่อไปนี้:
ก) 2NH 3 (g) ⇄ N 2 (g) + H 2 (g);
b) CO 2 (cr) ⇄ CO 2 (g);
ค) 2NO (ก.) + O 2 (ก.) = 2NO 2 (ก.);
ง) 2H 2 S (ก.) + 3O 2 = 2H 2 O (ล.) + 2SO 2 (ก.);
จ) 2CH 3 OH (ก) + 3O 2 (ก) = 4H 2 O (ก) + 2CO 2 (ก)
63. ซึ่งใน กรณีต่อไปนี้ปฏิกิริยาเกิดขึ้นได้ที่อุณหภูมิใดๆ: a) ΔH°< 0, ΔS°>0; b) Δ Н°<0, ΔS°<0; в) Δ Н°>0, ∆S°> 0 ?
64. ในกรณีใดต่อไปนี้ที่ปฏิกิริยาเป็นไปไม่ได้ที่อุณหภูมิใดๆ: a) ΔН°> 0, ΔS°> 0; b) ΔН°>0, ΔS°<0; в) Δ Н°<0, ΔS°<0 ?
65. ถ้าΔΗ°<0 и ΔS°<0 ,
ปฏิกิริยาใดสามารถเกิดขึ้นได้เองตามธรรมชาติ?
ก)| ∆N°| > |T∆S°|; ข)| ∆N°| > |TΔS°| -
66. สิ่งที่มีอิทธิพลต่อระบบสามารถเปลี่ยนสมดุลของระบบได้:
ก) N 2 (g) + 3H 2 (g) ⇄ 2NH 3 (g);
ข) 4Fe (cr) + 3O 2 (g) ⇄ 2Fe 2 O 3 (cr);
ค) SO 2 (g) + O 2 (g) ⇄ 2SO 3 (g)
67. สมดุลจะเปลี่ยนไปในทิศทางใดเมื่ออุณหภูมิในระบบสูงขึ้น:
1) COCl 2 ⇄ CO +Cl 2 ; ΔН°=113 กิโลจูล;
2) 2CO ⇄ CO 2 + C; ΔН°=-171 กิโลจูล;
3) 2SO 3 ⇄ 2SO 2 + O 2; ΔН°=192 กิโลจูล
68. สมดุลจะเปลี่ยนไปในทิศทางใดเมื่อความดันในระบบเพิ่มขึ้น:
1) H 2 (g) + S (cr) ⇄ H 2 S (g);
2) 2CO (ก.) ⇄ CO 2 (ก.) + C (ก.);
3) 4HCl (g) + O 2 (g) ⇄ 2H 2 O (g) + 2Cl 2 (g)
69. ความสมดุลของปฏิกิริยาต่อไปนี้จะได้รับผลกระทบอย่างไร:
CaCO 3 (cr) ⇄ CaO (cr) + CO 2 (g); ΔН°=178 กิโลจูล;
2CO (ก.) + O 2 (ก.) ⇄ 2CO 2; ΔН°=-566 กิโลจูล;
N 2 (ก.) + O 2 (ก.) ⇄ 2NO (ก.); ΔН°=180 กิโลจูล
ก) อุณหภูมิเพิ่มขึ้น
b) แรงกดดันเพิ่มขึ้น?
70. ใช้ข้อมูลอ้างอิงค้นหาค่าโดยประมาณของอุณหภูมิซึ่งค่าคงที่สมดุลของปฏิกิริยาสำหรับการก่อตัวของก๊าซน้ำ
C (ก.) + H 2 O (ก.) ⇄ CO (ก.) + H 2 (ก.)
เท่ากับ 1 ละเลยการพึ่งพาΔH o และ S o กับอุณหภูมิ
71. ค่าคงที่สมดุล K p ของปฏิกิริยา CO + Cl 2 ⇄ COCl 2 ที่ 600 o C เท่ากับ 1.67 * 10 -6 คำนวณ Kc สำหรับปฏิกิริยาที่อุณหภูมิที่กำหนด
72. ความยืดหยุ่นของการแยกตัวของแมกนีเซียมคาร์บอเนตที่ 1,000 K คือ 42189 Pa และที่ 1,020 K คือ 80313 Pa กำหนดผลกระทบทางความร้อนของปฏิกิริยา MgCO 3 ⇄ MgO + CO 2 และอุณหภูมิที่ความยืดหยุ่นของการแยกตัวของแมกนีเซียมคาร์บอเนตจะเท่ากับ 1 Pa
สมดุลเคมีคือสถานะของปฏิกิริยาเคมีที่ผันกลับได้
เอเอ+ ขบี= คซี+ งง,
โดยที่ความเข้มข้นของสารตั้งต้นในส่วนผสมของปฏิกิริยาไม่เปลี่ยนแปลงเมื่อเวลาผ่านไป สภาวะสมดุลเคมีมีลักษณะเฉพาะ ค่าคงที่สมดุลเคมี:
ที่ไหน ซี ฉัน– ความเข้มข้นของส่วนประกอบใน สมดุลส่วนผสมที่สมบูรณ์แบบ
ค่าคงที่สมดุลสามารถแสดงในรูปของเศษส่วนโมลสมดุลได้ เอ็กซ์ ฉันส่วนประกอบ:
สำหรับปฏิกิริยาที่เกิดขึ้นในเฟสก๊าซ จะสะดวกในการแสดงค่าคงที่สมดุลในรูปของแรงดันย่อยสมดุล พี ฉันส่วนประกอบ:
สำหรับก๊าซในอุดมคติ พี ฉัน = ซี ฉัน RTและ พี ฉัน = เอ็กซ์ ไอ พี, ที่ไหน ปคือความดันรวม ดังนั้น เคพี, เคซีและ เคเอ็กซ์มีความสัมพันธ์กันด้วยความสัมพันธ์ดังต่อไปนี้
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
ค่าคงที่สมดุลสัมพันธ์กับ อาร์จี o ปฏิกิริยาเคมี:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
เปลี่ยน อาร์จีหรือ อาร์ เอฟในปฏิกิริยาเคมีภายใต้แรงกดดันบางส่วน (ไม่จำเป็นต้องสมดุล) พี ฉันหรือความเข้มข้น ซี ฉันส่วนประกอบสามารถคำนวณได้โดยใช้สมการ ไอโซเทอร์มของปฏิกิริยาเคมี (ไม่ใช่ไอโซเทอร์มของฮอฟฟ์):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
ตาม หลักการของเลอ ชาเตอลิเยร์หากอิทธิพลภายนอกเกิดขึ้นกับระบบที่อยู่ในสมดุล ความสมดุลก็จะเปลี่ยนไปเพื่อลดผลกระทบของอิทธิพลภายนอก ดังนั้นการเพิ่มขึ้นของความดันจะเปลี่ยนสมดุลไปสู่การลดลงของจำนวนโมเลกุลของก๊าซ การเพิ่มส่วนประกอบของปฏิกิริยาใดๆ ลงในส่วนผสมสมดุลจะเปลี่ยนสมดุลไปสู่ปริมาณของส่วนประกอบนี้ที่ลดลง อุณหภูมิที่เพิ่มขึ้น (หรือลดลง) จะเปลี่ยนสมดุลไปสู่ปฏิกิริยาที่เกิดจากการดูดซับ (ปล่อย) ความร้อน
การพึ่งพาเชิงปริมาณของค่าคงที่สมดุลของอุณหภูมิอธิบายไว้ในสมการ ไอโซบาร์ปฏิกิริยาเคมี (ไอโซบาร์ของแวนท์ ฮอฟฟ์)
![]() (9.9)
(9.9)
และ ไอโซชอร์ของปฏิกิริยาเคมี (แทน ฮอฟฟ์ ไอโซชอร์ส)
![]() . (9.10)
. (9.10)
การอินทิเกรตสมการ (9.9) ภายใต้สมมติฐานที่ว่า อาร์ เอชปฏิกิริยาไม่ขึ้นอยู่กับอุณหภูมิ (ซึ่งเป็นจริงในช่วงอุณหภูมิที่แคบ) ให้:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
ที่ไหน ซี –ค่าคงที่การรวม ดังนั้นการพึ่งพาอาศัยกัน เคป จาก 1 /ตจะต้องเป็นเส้นตรง และความชันของเส้นตรงคือ – อาร์ เอช/ร.
บูรณาการภายใน เค 1 , เค 2 และ ต 1, ต 2 ให้:
 (9.13)
(9.13)
 (9.14)
(9.14)
เมื่อใช้สมการนี้ เมื่อทราบค่าคงที่สมดุลที่อุณหภูมิต่างกัน 2 ค่า เราก็สามารถคำนวณได้ อาร์ เอชปฏิกิริยา ตามนั้นให้รู้ อาร์ เอชปฏิกิริยาและค่าคงที่สมดุลที่อุณหภูมิหนึ่ง คุณสามารถคำนวณค่าคงที่สมดุลที่อุณหภูมิอื่นได้
ตัวอย่าง
CO(ก.) + 2H 2 (ก.) = CH 3 OH(ก.)
ที่ 500 ก. ฉ G โอสำหรับ CO(g) และ CH 3 OH(g) ที่ 500 K เท่ากับ –155.41 kJ โมล –1 และ –134.20 กิโลจูล โมล –1 ตามลำดับ
สารละลาย. ไปปฏิกิริยา:
อาร์ โก= ฉ G โอ(ช 3 โอ้) – ฉ G โอ(CO) = –134.20 – (–155.41) = 21.21 กิโลจูล โมล –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
ตัวอย่างที่ 9-2 ค่าคงที่สมดุลของปฏิกิริยา
เท่ากับ เค P = 1.64 10 –4 ที่ 400 o C ต้องใช้แรงดันรวมเท่าใดกับส่วนผสมที่เท่ากันของ N 2 และ H 2 เพื่อให้ 10% ของ N 2 กลายเป็น NH 3 ก๊าซถือเป็นอุดมคติ
สารละลาย. ปล่อยให้โมลของ N 2 ทำปฏิกิริยา แล้ว
| ยังไม่มีข้อความ 2 (ก.) | + | 3H 2 (ก.) | = | 2NH 3 (ก.) | |
| ปริมาณเดิม | 1 | 1 | |||
| ปริมาณสมดุล | 1– | 1–3 | 2 (รวม: 2–2) | ||
| เศษส่วนของโมลสมดุล: |
เพราะฉะนั้น, เคเอ็กซ์ = 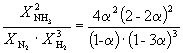 และ เค พี = เค X . ป –2
=
และ เค พี = เค X . ป –2
=  .
.
เราได้การแทน = 0.1 ลงในสูตรผลลัพธ์
1.64 10 –4 = , ที่ไหน ป= 51.2 เอทีเอ็ม
, ที่ไหน ป= 51.2 เอทีเอ็ม
ตัวอย่างที่ 9-3 ค่าคงที่สมดุลของปฏิกิริยา
CO(ก.) + 2H 2 (ก.) = CH 3 OH(ก.)
ที่ 500 K เท่ากับ เคพ = 6.09 10 –3 . ส่วนผสมของปฏิกิริยาประกอบด้วย 1 โมล CO, 2 โมล H 2 และก๊าซเฉื่อย 1 โมล (N 2) ถูกให้ความร้อนถึง 500 K และความดันรวม 100 atm คำนวณองค์ประกอบของส่วนผสมสมดุล
สารละลาย. ปล่อยให้ CO หนึ่งโมลทำปฏิกิริยา แล้ว
| ฟันเฟือง) | + | 2H 2 (ก.) | = | CH3OH(ก.) | |
| ปริมาณเดิม: | 1 | 2 | 0 | ||
| ปริมาณสมดุล: | 1– | 2–2 | |||
| ส่วนผสมทั้งหมดในสภาวะสมดุล: | ส่วนประกอบ 3–2 โมล + 1 โมล N 2 = 4–2 โมล | ||||
| เศษส่วนของโมลสมดุล | |||||
เพราะฉะนั้น, เคเอ็กซ์ =  และ เค พี = เค X . ป–2 =
และ เค พี = เค X . ป–2 = ![]() .
.
ดังนั้น 6.09 10 –3 = ![]() .
.
เมื่อแก้สมการนี้ เราได้ = 0.732 ดังนั้น เศษส่วนโมลของสารในส่วนผสมสมดุลจะเท่ากับ: = 0.288, = 0.106, = 0.212 และ = 0.394
ตัวอย่างที่ 9-4 สำหรับปฏิกิริยา
N 2 (ก.) + 3H 2 (ก.) = 2NH 3 (ก.)
ที่ 298 ก เค P = 6.0 10 5 , ก ฉ ฮ โอ(NH3) = –46.1 กิโลจูล โมล –1 . ประมาณค่าคงที่สมดุลที่ 500 K
สารละลาย. เอนทาลปีโมลาร์มาตรฐานของปฏิกิริยาคือ
ร ฮ โอ= 2ฉ ฮ โอ(NH3) = –92.2 กิโลจูล โมล –1 .
ตามสมการ (9.14)  =
=
เลน (6.0 10 5) + ![]() = –1.73 จากที่ไหน เค 2 =
0.18.
= –1.73 จากที่ไหน เค 2 =
0.18.
โปรดทราบว่าค่าคงที่สมดุลของปฏิกิริยาคายความร้อนจะลดลงตามอุณหภูมิที่เพิ่มขึ้น ซึ่งสอดคล้องกับหลักการของเลอ ชาเตอลิเยร์
งาน
- ที่ 1273 K และความดันรวม 30 atm ในส่วนผสมที่สมดุล
- ที่อุณหภูมิ 2000 o C และความดันรวม 1 atm น้ำ 2% จะแยกตัวออกเป็นไฮโดรเจนและออกซิเจน คำนวณค่าคงที่สมดุลของปฏิกิริยา
- ค่าคงที่สมดุลของปฏิกิริยา
- ค่าคงที่สมดุลของปฏิกิริยา
- ถังขนาด 3 ลิตรที่บรรจุ 1.79 10 –2 โมล I 2 ถูกให้ความร้อนถึง 973 K ความดันในภาชนะที่สมดุลกลายเป็น 0.49 atm สมมติว่าก๊าซมีอุดมคติ ให้คำนวณค่าคงที่สมดุลที่ 973 K สำหรับปฏิกิริยา
- สำหรับปฏิกิริยา
- สำหรับปฏิกิริยา
- ภาชนะขนาด 1 ลิตรที่ประกอบด้วย 0.341 โมล PCl 5 และ 0.233 โมล N 2 ได้รับความร้อนที่ 250 o C ความดันรวมในภาชนะที่สภาวะสมดุลกลายเป็น 29.33 atm สมมติว่าก๊าซทั้งหมดอยู่ในอุดมคติ ให้คำนวณค่าคงที่สมดุลที่ 250 o C สำหรับปฏิกิริยาที่เกิดขึ้นในถัง
- ค่าคงที่สมดุลของปฏิกิริยา
- ที่อุณหภูมิ 25 o C ฉ G โอ(NH3) = –16.5 กิโลจูล โมล –1 . อาร์จีคำนวณ
- ปฏิกิริยาการก่อตัวของ NH 3 ที่ความดันบางส่วนของ N 2, H 2 และ NH 3 เท่ากับ 3 atm, 1 atm และ 4 atm ตามลำดับ ปฏิกิริยาจะเกิดขึ้นไปในทิศทางใดภายใต้สภาวะเหล่านี้?
- ค่าคงที่สมดุลของปฏิกิริยาเฟสก๊าซของไอโซเมอไรเซชันของพิมเสน (C 10 H 17 OH) ลงในไอโซบอร์นอลคือ 0.106 ที่ 503 K วางส่วนผสมของพิมเสน 7.5 กรัมและไอโซบอร์นอล 14.0 กรัมในภาชนะขนาด 5 ลิตรแล้วเก็บไว้ ที่ 503 K จนกระทั่งถึงจุดสมดุล
- คำนวณเศษส่วนโมลและมวลของพิมเสนและไอโซบอร์นอลในส่วนผสมสมดุล
- สำหรับปฏิกิริยา ความดันรวมของ Cl 2 จะเท่ากับ 0.10 บาร์ที่ความดันรวมเท่าใด
- ที่อุณหภูมิ 400 o C เท่ากัน
- ระดับการแยกตัวของ PCl 5 จะเป็นเท่าใดหากเพิ่ม N 2 เข้าสู่ระบบเพื่อให้ความดันย่อยของไนโตรเจนอยู่ที่ 0.9 atm
- N 2 (ก.) + O 2 (ก.) = 2NO (ก.)
K พี = 2.5 · 10 –3 . - ส่วนผสมสมดุลของ N 2, O 2, NO และก๊าซเฉื่อยที่ความดันรวม 1 บาร์ประกอบด้วย 80% (โดยปริมาตร) N 2 และ 16% O 2
CO 2 (ก.) + C (ทีวี) = 2CO (ก.)
มี 17% (โดยปริมาตร) CO 2 . CO 2 จะบรรจุอยู่ในก๊าซที่ความดันรวม 20 atm กี่เปอร์เซ็นต์ ก๊าซจะมี CO 2 25% ที่ความดันเท่าใด
H 2 O (g) = H 2 (g) + 1/2O 2 (g) ภายใต้เงื่อนไขเหล่านี้
CO(ก) + H 2 O(ก) = CO 2 (ก) + H 2 (ก)
ที่ 500 o C เท่ากัน เคพี= 5.5 ส่วนผสมที่ประกอบด้วย 1 โมล CO และ 5 โมล H 2 O ถูกให้ความร้อนจนถึงอุณหภูมินี้ คำนวณเศษส่วนโมลของ H 2 O ในส่วนผสมสมดุล
ไม่มี 2 O 4 (ก.) = 2NO 2 (ก.)
ที่ 25 o C เท่ากัน เคพี= 0.143. คำนวณความดันที่จะเกิดขึ้นในภาชนะที่มีปริมาตร 1 ลิตรโดยวาง N 2 O 4 1 กรัมไว้ที่อุณหภูมินี้
ฉัน 2 (ก.) = 2I (ก.)
ที่อุณหภูมิ 250 o C อาร์จี o = –2508 เจ โมล –1 ระดับการแปลง PCl 5 เป็น PCl 3 และ Cl 2 ที่ 250 o C จะเป็น 30% ที่ความดันรวมเท่าใด
2HI(g) = H 2 (g) + I 2 (g)
ค่าคงที่สมดุล เค P = 1.83 · 10 –2 ที่ 698.6 K HI จะเกิดขึ้นได้กี่กรัมเมื่อให้ความร้อน I 2 10 กรัม และ H 2 0.2 กรัมถึงอุณหภูมินี้ในภาชนะขนาด 3 ลิตร ความกดดันบางส่วนของ H 2, I 2 และ HI คืออะไร?
PCl 5 (g) = PCl 3 (g) + Cl 2 (g)
CO(ก.) + 2H 2 (ก.) = CH 3 OH(ก.)
ที่ 500 K เท่ากับ เคพ = 6.09 10 –3 . คำนวณความดันทั้งหมดที่จำเป็นในการผลิตเมทานอลในอัตราผลตอบแทน 90% หากใช้ CO และ H2 ในอัตราส่วน 1:2
CO(ก.) + 2H 2 (ก.) = CH 3 OH(ก.)
ปฏิกิริยาคายความร้อน ตอยู่ในสภาวะสมดุลที่ 500 K และ 10 bar หากก๊าซมีอุดมคติ ปัจจัยต่อไปนี้จะส่งผลต่อผลผลิตของเมทานอลอย่างไร: ก) เพิ่มขึ้น ป- ข) การส่งเสริมการขาย - c) เติมก๊าซเฉื่อยที่วี ป= const; ป d) เติมก๊าซเฉื่อยที่
สมดุลในการเกิดปฏิกิริยา
2NOCl(ก) = 2NO(ก) + Cl 2 (ก) อาร์ โกตั้งไว้ที่ 227 o C และความดันรวม 1.0 บาร์ เมื่อความดันย่อยของ NOCl เท่ากับ 0.64 บาร์ (ในตอนแรกมีเพียง NOCl เท่านั้น) คำนวณ
N 2 (ก.) + 3H 2 (ก.) = 2NH 3 (ก.)
คำนวณความดันรวมที่ต้องใช้กับส่วนผสม 3 ส่วน H 2 และ 1 ส่วน N 2 เพื่อให้ได้ส่วนผสมสมดุลที่มี 10% NH 3 โดยปริมาตรที่ 400 o C ค่าคงที่สมดุลสำหรับปฏิกิริยา เค = 1.60 10 –4 .
ที่ 250 o C และความดันรวม 1 atm PCl 5 จะถูกแยกออกจากกัน 80% โดยปฏิกิริยา
PCl 5 (g) = PCl 3 (g) + Cl 2 (g)
ความดันรวมจะคงอยู่ที่ 1 atm
ที่ 2000 o C สำหรับปฏิกิริยา
NO มีกี่เปอร์เซ็นต์โดยปริมาตร? ความดันย่อยของก๊าซเฉื่อยมีค่าเท่าใด เค = –1.04 –1088 /ต +1.51 10 5 /ต 2 .
คำนวณเอนทาลปีมาตรฐานของปฏิกิริยาที่มีค่าคงที่สมดุล
ก) เพิ่มขึ้น 2 เท่า b) ลดลง 2 เท่าเมื่ออุณหภูมิเปลี่ยนจาก 298 K เป็น 308 K
การพึ่งพาค่าคงที่สมดุลของปฏิกิริยา 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) ที่อุณหภูมิระหว่าง 300 K ถึง 600 K อธิบายโดยสมการ
ln
คำถามการศึกษา
ก) เพิ่มขึ้น 2 เท่า b) ลดลง 2 เท่าเมื่ออุณหภูมิเปลี่ยนจาก 298 K เป็น 308 K
สถานะของความสมดุล.
ค่าคงที่สมดุล
การคำนวณความเข้มข้นของสมดุล
 การเปลี่ยนแปลงในสมดุลเคมี หลักการของเลอ ชาเตอลิเยร์ ปฏิกิริยาที่เกิดขึ้นพร้อมกันในทิศทางตรงกันข้ามภายใต้สภาวะเดียวกันเรียกว่าปฏิกิริยาย้อนกลับได้พิจารณาปฏิกิริยาผันกลับได้ที่เกิดขึ้นในระบบปิด
การเปลี่ยนแปลงในสมดุลเคมี หลักการของเลอ ชาเตอลิเยร์ ปฏิกิริยาที่เกิดขึ้นพร้อมกันในทิศทางตรงกันข้ามภายใต้สภาวะเดียวกันเรียกว่าปฏิกิริยาย้อนกลับได้พิจารณาปฏิกิริยาผันกลับได้ที่เกิดขึ้นในระบบปิด
อัตราของปฏิกิริยาไปข้างหน้าอธิบายได้ด้วยสมการ:  ราคา =
ราคา =
ปฏิกิริยาที่เกิดขึ้นพร้อมกันในทิศทางตรงกันข้ามภายใต้สภาวะเดียวกันเรียกว่าปฏิกิริยาย้อนกลับได้เค
ราคา [A] [B], ที่ไหน pr – อัตราการเกิดปฏิกิริยาโดยตรง pr คือค่าคงที่อัตราของปฏิกิริยาไปข้างหน้าเมื่อเวลาผ่านไปความเข้มข้นของสารรีเอเจนต์  ก
ก
และ ที่ไหน pr – อัตราการเกิดปฏิกิริยาโดยตรง pr คือค่าคงที่อัตราของปฏิกิริยาไปข้างหน้าใน ค pr – อัตราการเกิดปฏิกิริยาโดยตรง ลดลง อัตราการเกิดปฏิกิริยาลดลง (รูปที่ 1 เส้นโค้งราคา) ที่ไหน pr – อัตราการเกิดปฏิกิริยาโดยตรง pr คือค่าคงที่อัตราของปฏิกิริยาไปข้างหน้า.
ปฏิกิริยาระหว่าง
 นำไปสู่การก่อตัวของสาร ปฏิกิริยาที่เกิดขึ้นพร้อมกันในทิศทางตรงกันข้ามภายใต้สภาวะเดียวกันเรียกว่าปฏิกิริยาย้อนกลับได้
ดี
นำไปสู่การก่อตัวของสาร ปฏิกิริยาที่เกิดขึ้นพร้อมกันในทิศทางตรงกันข้ามภายใต้สภาวะเดียวกันเรียกว่าปฏิกิริยาย้อนกลับได้
ดี
อัตราของปฏิกิริยาไปข้างหน้าอธิบายได้ด้วยสมการ:  รอบ – อัตราการเกิดปฏิกิริยาย้อนกลับ
รอบ – อัตราการเกิดปฏิกิริยาย้อนกลับ
ปฏิกิริยาที่เกิดขึ้นพร้อมกันในทิศทางตรงกันข้ามภายใต้สภาวะเดียวกันเรียกว่าปฏิกิริยาย้อนกลับได้ rev คือค่าคงที่อัตราของปฏิกิริยาย้อนกลับ
เป็นความเข้มข้นของสาร ค pr – อัตราการเกิดปฏิกิริยาโดยตรง ลดลง อัตราการเกิดปฏิกิริยาลดลง (รูปที่ 1 เส้นโค้งเพิ่มขึ้น อัตราของปฏิกิริยาย้อนกลับจะเพิ่มขึ้น (รูปที่ 1 เส้นโค้ง  เอ่อ)
เอ่อ)

รูปที่ 1. การเปลี่ยนแปลงอัตราการเกิดปฏิกิริยาไปข้างหน้าและย้อนกลับเมื่อเวลาผ่านไป
หลังจากนั้นไม่นาน อัตราของปฏิกิริยาไปข้างหน้าและย้อนกลับจะเท่ากัน:
 ราคา =
ราคา =  อ๊าก
อ๊าก
สถานะของระบบนี้เรียกว่า สถานะของความสมดุล .
ในสภาวะสมดุล ความเข้มข้นของผู้เข้าร่วมทั้งหมดจะหยุดเปลี่ยนแปลงเมื่อเวลาผ่านไป . ความเข้มข้นดังกล่าวเรียกว่า สมดุล .
สมดุลเคมี – นี้ ความสมดุลแบบไดนามิกความคงที่ของความเข้มข้นของสารที่อยู่ในระบบปิดเป็นผลมาจากกระบวนการทางเคมีที่ดำเนินอยู่อย่างต่อเนื่อง อัตราของปฏิกิริยาไปข้างหน้าและย้อนกลับไม่เท่ากับศูนย์ แต่อัตราที่สังเกตได้ของกระบวนการจะเท่ากับศูนย์
ความเท่าเทียมกันของอัตราการเกิดปฏิกิริยาไปข้างหน้าและย้อนกลับเป็นสภาวะจลน์ของสมดุลเคมี
2. ค่าคงที่สมดุล
เมื่ออัตราปฏิกิริยาเดินหน้าและถอยหลังเท่ากัน
 ราคา =
ราคา =  อ๊าก
อ๊าก
ความเท่าเทียมกันเป็นจริง
ปฏิกิริยาที่เกิดขึ้นพร้อมกันในทิศทางตรงกันข้ามภายใต้สภาวะเดียวกันเรียกว่าปฏิกิริยาย้อนกลับได้ราคา [A] [B] = ปฏิกิริยาที่เกิดขึ้นพร้อมกันในทิศทางตรงกันข้ามภายใต้สภาวะเดียวกันเรียกว่าปฏิกิริยาย้อนกลับได้ถึง [C] [D],
ที่ไหน [ ก], [บี], [กับ], [ลดลง อัตราการเกิดปฏิกิริยาลดลง (รูปที่ 1 เส้นโค้ง] – ความเข้มข้นของสารที่สมดุล
เนื่องจากค่าคงที่อัตราไม่ขึ้นอยู่กับความเข้มข้น ความเท่าเทียมกันจึงสามารถเขียนแตกต่างออกไปได้:

อัตราส่วนของอัตราคงที่ของปฏิกิริยาไปข้างหน้าและย้อนกลับ ( ปฏิกิริยาที่เกิดขึ้นพร้อมกันในทิศทางตรงกันข้ามภายใต้สภาวะเดียวกันเรียกว่าปฏิกิริยาย้อนกลับได้ ราคา / ปฏิกิริยาที่เกิดขึ้นพร้อมกันในทิศทางตรงกันข้ามภายใต้สภาวะเดียวกันเรียกว่าปฏิกิริยาย้อนกลับได้ อ๊าก ) เรียกว่าค่าคงที่สมดุลเคมี:
|
|
ความสมดุลทางเคมีที่แท้จริงจะเกิดขึ้นได้ก็ต่อเมื่อขั้นตอนเบื้องต้นทั้งหมดของกลไกการเกิดปฏิกิริยาอยู่ในสภาวะสมดุลเท่านั้น ไม่ว่ากลไกของปฏิกิริยาโดยตรงและปฏิกิริยาย้อนกลับจะซับซ้อนเพียงใด ในสภาวะสมดุล กลไกเหล่านี้จะต้องรับประกันการเปลี่ยนแปลงปริมาณสัมพันธ์ของสารตั้งต้นไปเป็นผลิตภัณฑ์ปฏิกิริยาและย้อนกลับ ซึ่งหมายความว่าผลรวมพีชคณิตของทุกขั้นตอนของกระบวนการเท่ากับสมการปริมาณสัมพันธ์ของปฏิกิริยา กล่าวคือ สัมประสิทธิ์ปริมาณสัมพันธ์แสดงถึงผลรวมของโมเลกุลของทุกขั้นตอนของกลไก
สำหรับปฏิกิริยาที่ซับซ้อน
AA + บีบี ซีซี + ดีดี
|
เค ส = |
สำหรับอุณหภูมิเดียวกัน อัตราส่วนผลคูณของความเข้มข้นสมดุลของผลิตภัณฑ์ปฏิกิริยาในหน่วยองศาเท่ากับค่าสัมประสิทธิ์ปริมาณสัมพันธ์ต่อผลคูณของความเข้มข้นสมดุลของสารเริ่มต้นในหน่วยองศาเท่ากับค่าสัมประสิทธิ์ปริมาณสัมพันธ์จะเป็นค่าคงที่.
นี่เป็นกฎข้อที่สองของกฎแห่งการกระทำมวลชน
การแสดงออกของค่าคงที่สมดุลของปฏิกิริยาที่ต่างกันนั้นรวมถึงความเข้มข้นของสารในสถานะของเหลวหรือก๊าซเท่านั้น เนื่องจากตามกฎแล้วความเข้มข้นของสารของแข็งจะคงที่
ตัวอย่างเช่น การแสดงออกของค่าคงที่สมดุลของปฏิกิริยาต่อไปนี้คือ
CO 2 (ก.) + C (ทีวี) 2 CO (ก.)
เขียนดังนี้:
ถึงค =  .
.
สมการค่าคงที่สมดุลแสดงให้เห็นว่าภายใต้สภาวะสมดุล ความเข้มข้นของสารทั้งหมดที่มีส่วนร่วมในปฏิกิริยาจะสัมพันธ์กัน ค่าตัวเลขของค่าคงที่สมดุลจะกำหนดอัตราส่วนของความเข้มข้นของสารที่ทำปฏิกิริยาทั้งหมดที่ควรอยู่ที่สมดุล
การเปลี่ยนแปลงความเข้มข้นของสารใดๆ เหล่านี้ทำให้เกิดการเปลี่ยนแปลงความเข้มข้นของสารอื่นๆ ทั้งหมด เป็นผลให้มีการสร้างความเข้มข้นใหม่ แต่ความสัมพันธ์ระหว่างความเข้มข้นเหล่านั้นสอดคล้องกับค่าคงที่สมดุลอีกครั้ง
ค่าคงที่สมดุลขึ้นอยู่กับ ลักษณะของสารตั้งต้นและอุณหภูมิ
ค่าคงที่สมดุลแสดงในรูปของความเข้มข้นของโมลาร์ของสารตั้งต้น ( ถึงกับ) และค่าคงที่สมดุลที่แสดงออกมาในรูปของแรงกดดันบางส่วนของสมดุล ( ถึงร) (ดู “พื้นฐานของอุณหพลศาสตร์เคมี”) มีความเชื่อมโยงกันด้วยความสัมพันธ์ต่อไปนี้:
ถึงร= เคกับRT , เคค = เคร / (RT) ,
โดยที่ คือการเปลี่ยนแปลงจำนวนโมลของก๊าซในปฏิกิริยา
การเปลี่ยนแปลงมาตรฐานของพลังงานกิ๊บส์คือ
G ที = - RT ln เคพี,
จี ต = ชม – ต ส.
หลังจากปรับด้านขวามือของสมการแล้ว:
- RT ln เคพี = ชม – ต ส
ln เค ร = - ชม / ( RT) + ส/ ร .
สมการไม่เพียงแต่กำหนดประเภทของการขึ้นต่อกันของค่าคงที่ของอุณหภูมิเท่านั้น แต่ยังแสดงให้เห็นว่าค่าคงที่นั้นถูกกำหนดโดยธรรมชาติของสารที่ทำปฏิกิริยาอีกด้วย
ค่าคงที่สมดุลไม่ได้ขึ้นอยู่กับความเข้มข้น (เช่นเดียวกับค่าคงที่ของอัตราการเกิดปฏิกิริยา) กลไกของปฏิกิริยา พลังงานกระตุ้น หรือการมีอยู่ของตัวเร่งปฏิกิริยา. ตัวอย่างเช่นการเปลี่ยนกลไกเมื่อแนะนำตัวเร่งปฏิกิริยาจะไม่ส่งผลกระทบต่อค่าตัวเลขของค่าคงที่สมดุล แต่แน่นอนว่าจะเปลี่ยนอัตราการถึงสถานะสมดุล
ค่าคงที่สมดุลเคมี
ลักษณะเชิงปริมาณของสมดุลเคมีคือ ค่าคงที่สมดุล ซึ่งสามารถแสดงในรูปของความเข้มข้นของความสมดุล C i , แรงกดดันบางส่วน P i หรือเศษส่วนของโมล X i ของสารตั้งต้น เพื่อเกิดปฏิกิริยาบางอย่าง
ค่าคงที่สมดุลที่สอดคล้องกันจะแสดงดังต่อไปนี้:



ค่าคงที่สมดุลคือค่าคุณลักษณะเฉพาะของปฏิกิริยาเคมีที่ผันกลับได้แต่ละชนิด ค่าคงที่สมดุลขึ้นอยู่กับลักษณะของสารตั้งต้นและอุณหภูมิเท่านั้น จากสมการสถานะของก๊าซในอุดมคติ ซึ่งเขียนเป็นความสัมพันธ์ P i = C i RT โดยที่ C i = n i /V และกฎของดาลตันสำหรับส่วนผสมของก๊าซในอุดมคติ แสดงโดยสมการ P = ΣP i จะได้ว่า เป็นไปได้ที่จะได้รับความสัมพันธ์ระหว่างความดันย่อย Pi, ความเข้มข้นของฟันกราม C i และเศษส่วนของโมล X i ขององค์ประกอบ i-th:
![]()
จากที่นี่เราได้รับความสัมพันธ์ระหว่าง K c , K p และ K x:
![]()
โดยที่ Δν คือการเปลี่ยนแปลงจำนวนโมลของสารก๊าซระหว่างปฏิกิริยา:
Δν = – ν 1 – ν 2 – ... + ν" 1 + ν" 2 + ...
ค่าของค่าคงที่สมดุล K x ตรงกันข้ามกับค่าคงที่สมดุล K c และ K p ขึ้นอยู่กับความดันรวม P
การแสดงออกของค่าคงที่สมดุลของปฏิกิริยาย้อนกลับเบื้องต้นสามารถหาได้จากแนวคิดทางจลน์ ให้เราพิจารณากระบวนการสร้างสมดุลในระบบซึ่ง ณ ช่วงเวลาแรกๆ มีเพียงสสารตั้งต้นเท่านั้นที่มีอยู่ อัตราของปฏิกิริยาไปข้างหน้า V 1 ในขณะนี้คือสูงสุด และอัตราของปฏิกิริยาย้อนกลับ V 2 จะเป็นศูนย์:
![]()
![]()
เมื่อความเข้มข้นของสารตั้งต้นลดลง ความเข้มข้นของผลิตภัณฑ์ที่ทำปฏิกิริยาจะเพิ่มขึ้น ดังนั้น อัตราของปฏิกิริยาไปข้างหน้าจะลดลง อัตราของปฏิกิริยาย้อนกลับจะเพิ่มขึ้น เห็นได้ชัดว่าหลังจากผ่านไประยะหนึ่ง อัตราของปฏิกิริยาไปข้างหน้าและย้อนกลับจะเท่ากัน หลังจากนั้นความเข้มข้นของสารที่ทำปฏิกิริยาจะหยุดเปลี่ยนแปลงนั่นคือ สมดุลเคมีจะเกิดขึ้น
สมมติว่า V 1 = V 2 เราสามารถเขียนได้:

ดังนั้นค่าคงที่สมดุลคืออัตราส่วนของค่าคงที่อัตราของปฏิกิริยาไปข้างหน้าและย้อนกลับ นี่แสดงถึงความหมายทางกายภาพของค่าคงที่สมดุล โดยแสดงจำนวนครั้งที่อัตราของปฏิกิริยาไปข้างหน้ามากกว่าอัตราของปฏิกิริยาย้อนกลับที่อุณหภูมิที่กำหนด และความเข้มข้นของสารที่ทำปฏิกิริยาทั้งหมดเท่ากับ 1 โมล/ลิตร อย่างไรก็ตาม ที่มาข้างต้นของนิพจน์สำหรับค่าคงที่สมดุลนั้นมีพื้นฐานมาจากสมมติฐานผิดๆ โดยทั่วไปที่ว่าอัตราการเกิดปฏิกิริยาเคมีเป็นสัดส่วนโดยตรงกับผลคูณของความเข้มข้นของสารตั้งต้น ซึ่งอยู่ในกำลังเท่ากับสัมประสิทธิ์ปริมาณสัมพันธ์ ดังที่ทราบกันดีว่า ในกรณีทั่วไป เลขชี้กำลังที่ความเข้มข้นของรีเอเจนต์ในสมการจลน์ของปฏิกิริยาเคมีไม่ตรงกับสัมประสิทธิ์ปริมาณสัมพันธ์
11. ปฏิกิริยารีดอกซ์: คำจำกัดความ แนวคิดพื้นฐาน แก่นแท้ของการเกิดออกซิเดชันและการรีดักชัน สารออกซิไดซ์ที่สำคัญที่สุดและตัวรีดิวซ์ของปฏิกิริยา
รีดอกซ์เรียกว่ากระบวนการที่มาพร้อมกับการกระจัดของอิเล็กตรอนจากอะตอมอิสระหรือพันธะหนึ่งไปยังอีกอะตอมหนึ่ง เนื่องจากในกรณีเช่นนี้ ระดับของการกระจัดไม่ได้สำคัญ แต่เป็นเพียงจำนวนอิเล็กตรอนที่ถูกแทนที่เท่านั้น จึงเป็นเรื่องปกติที่จะพิจารณาตามอัตภาพว่าการกระจัดจะสมบูรณ์อยู่เสมอ และพูดถึงการหดตัวหรือการกระจัดของอิเล็กตรอน
ถ้าอะตอมหรือไอออนของธาตุให้หรือรับอิเล็กตรอน ในกรณีแรกสถานะออกซิเดชันของธาตุนั้นจะเพิ่มขึ้น และมันจะไปอยู่ในรูปแบบออกซิไดซ์ (OR) และในกรณีที่สอง สถานะออกซิเดชันจะลดลง และธาตุจะไป ให้อยู่ในรูปแบบรีดิวซ์ (RF) ทั้งสองรูปแบบก่อให้เกิดคู่รีดอกซ์คอนจูเกต ปฏิกิริยารีดอกซ์แต่ละปฏิกิริยาเกี่ยวข้องกับคอนจูเกตสองคู่ หนึ่งในนั้นสอดคล้องกับการเปลี่ยนแปลงของตัวออกซิไดซ์ที่รับอิเล็กตรอนในรูปแบบรีดิวซ์ (OP 1 → VF 1) และอีกอันสอดคล้องกับการเปลี่ยนแปลงของตัวรีดิวซ์ที่บริจาคอิเล็กตรอนให้อยู่ในรูปแบบออกซิไดซ์ (VF 2 → OF 2 ), ตัวอย่างเช่น:
Cl 2 + 2 ผม – → 2 Cl – + ผม 2
จาก 1 VF 1 VF 2 จาก 2
(ในที่นี้ Cl 2 เป็นตัวออกซิไดซ์ ส่วน I เป็นตัวรีดิวซ์)
ดังนั้นปฏิกิริยาเดียวกันจึงเป็นทั้งกระบวนการออกซิเดชั่นของตัวรีดิวซ์และกระบวนการรีดิวซ์ของตัวออกซิไดซ์เสมอ
สามารถหาค่าสัมประสิทธิ์ในสมการของปฏิกิริยารีดอกซ์ได้ วิธีสมดุลทางอิเล็กทรอนิกส์และความสมดุลของอิเล็กตรอน-ไอออน ในกรณีแรก จำนวนอิเล็กตรอนที่รับหรือปล่อยจะถูกกำหนดโดยความแตกต่างในสถานะออกซิเดชันขององค์ประกอบในสถานะเริ่มต้นและสถานะสุดท้าย ตัวอย่าง:
HN 5+ O 3 + H 2 S 2– → N 2+ O + S + H 2 O
ในปฏิกิริยานี้ สององค์ประกอบจะเปลี่ยนสถานะออกซิเดชัน: ไนโตรเจนและซัลเฟอร์ สมการสมดุลทางอิเล็กทรอนิกส์:
เศษส่วนของโมเลกุล H 2 S ที่แยกออกจากกันไม่มีนัยสำคัญ ดังนั้น ไม่ใช่ S 2– ไอออน แต่โมเลกุล H 2 S จะถูกแทนที่ในสมการ ขั้นแรก ความสมดุลของอนุภาคจะถูกทำให้เท่ากัน ในสภาพแวดล้อมที่เป็นกรด การปรับสมดุลจะใช้ไฮโดรเจนไอออนที่เติมลงในรูปแบบออกซิไดซ์ และโมเลกุลของน้ำที่ถูกเติมลงในรูปแบบรีดิวซ์ จากนั้นความสมดุลของประจุจะถูกทำให้เท่ากัน และทางด้านขวาของเส้นจะมีการระบุค่าสัมประสิทธิ์ที่ทำให้จำนวนอิเล็กตรอนที่ได้รับและรับเท่ากัน หลังจากนั้นสมการสรุปจะเขียนไว้ด้านล่างโดยคำนึงถึงค่าสัมประสิทธิ์:
เราได้รับสมการไอออน-โมเลกุลแบบย่อ โดยการเติม Na + และ K + ไอออนลงไป เราจะได้สมการที่คล้ายกันในรูปแบบเต็ม เช่นเดียวกับสมการโมเลกุล:
นาโน 2 + 2 KMnO 4 + 2 KOH → นาโน 3 + 2 K 2 MnO 4 + H 2 O
ในสภาพแวดล้อมที่เป็นกลาง ความสมดุลของอนุภาคจะถูกทำให้เท่ากันโดยการเติมโมเลกุลของน้ำทางด้านซ้ายของปฏิกิริยาครึ่งหนึ่ง และไอออน H + หรือ OH – จะถูกเติมทางด้านขวา:
ฉัน 2 + Cl 2 + H 2 O → HIO 3 + HCl
สารตั้งต้นไม่ใช่กรดหรือเบส ดังนั้น ในช่วงเริ่มต้นของปฏิกิริยา สภาพแวดล้อมในสารละลายจึงใกล้เคียงกับความเป็นกลาง สมการครึ่งปฏิกิริยา:
| ฉัน 2 + 6 H 2 O + 10e → 2 IO 3 – + 12 H + | |
| Cl 2 + 2e → 2 Cl – | |
| ฉัน 2 + 5 Cl 2 + 6 H 2 O → 2 IO 3 – + 12 H + + 10 Cl – |
สมการปฏิกิริยาในรูปแบบโมเลกุล:
ฉัน 2 + 5 Cl 2 + 6 H 2 O → 2 HIO 3 + 10 HCl
สารออกซิไดซ์ที่สำคัญและสารรีดิวซ์ การจำแนกประเภทของปฏิกิริยารีดอกซ์
ขีด จำกัด ของการเกิดออกซิเดชันและการลดลงขององค์ประกอบแสดงโดยค่าสูงสุดและต่ำสุดของสถานะออกซิเดชัน * ในสภาวะสุดขั้วเหล่านี้ ซึ่งกำหนดโดยตำแหน่งในตารางธาตุ องค์ประกอบมีโอกาสที่จะแสดงฟังก์ชันเดียวเท่านั้น - ตัวออกซิไดเซอร์หรือตัวลด ดังนั้นสารที่มีองค์ประกอบในสถานะออกซิเดชันเหล่านี้จึงเป็นเพียงตัวออกซิไดซ์ (HNO 3, H 2 SO 4, HClO 4, KMnO 4, K 2 Cr 2 O 7 ฯลฯ ) หรือเฉพาะตัวรีดิวซ์ (NH 3, H 2 S, ไฮโดรเจนเฮไลด์, นา 2 S 2 O 3 เป็นต้น) สารที่มีองค์ประกอบในสถานะออกซิเดชันระดับกลางสามารถเป็นได้ทั้งตัวออกซิไดซ์และตัวรีดิวซ์ (HClO, H 2 O 2, H 2 SO 3 เป็นต้น)
ปฏิกิริยารีดอกซ์แบ่งออกเป็นสามประเภทหลัก: ปฏิกิริยาระหว่างโมเลกุล, ปฏิกิริยาภายในโมเลกุล และความไม่สมส่วน
ประเภทแรกประกอบด้วยกระบวนการที่อะตอมขององค์ประกอบออกซิไดซ์และองค์ประกอบรีดิวซ์เป็นส่วนหนึ่งของโมเลกุลที่แตกต่างกัน
ปฏิกิริยาที่สารออกซิไดซ์และตัวรีดิวซ์ในรูปอะตอมของธาตุต่าง ๆ อยู่ในโมเลกุลเดียวกันเรียกว่าปฏิกิริยาภายในโมเลกุล ตัวอย่างเช่น การสลายตัวทางความร้อนของโพแทสเซียมคลอเรตตามสมการ:
2 KClO 3 → 2 KCl + 3 O 2
ปฏิกิริยาที่ไม่สมส่วนคือกระบวนการที่ตัวออกซิไดซ์และตัวรีดิวซ์เป็นองค์ประกอบเดียวกันในสถานะออกซิเดชันเดียวกัน ซึ่งในปฏิกิริยาทั้งลดลงและเพิ่มขึ้น ตัวอย่างเช่น
3 HClO → HClO 3 + 2 HCl
ปฏิกิริยาความไม่สมส่วนย้อนกลับก็เป็นไปได้เช่นกัน ซึ่งรวมถึงกระบวนการภายในโมเลกุลซึ่งตัวออกซิไดซ์และตัวรีดิวซ์เป็นองค์ประกอบเดียวกัน แต่อยู่ในรูปแบบของอะตอมที่มีสถานะออกซิเดชันต่างกัน และปรับระดับพวกมันอันเป็นผลมาจากปฏิกิริยา เป็นต้น
บทความใหม่
- ระยะเวลาพักฟื้นหลังการผ่าตัดเต้านม - คำแนะนำของแพทย์และผลเสียที่อาจเกิดขึ้น
- ลักษณะการหลั่งระหว่างตั้งครรภ์ การหลั่งจะยาวนานเหมือนน้ำมูกระหว่างตั้งครรภ์
- การครอบแก้ว (ทางการแพทย์) ระหว่างตั้งครรภ์: เป็นไปได้ไหมที่แพทย์เท่านั้นที่ตัดสินใจ!
- การครอบแก้ว (ทางการแพทย์) ระหว่างตั้งครรภ์: เป็นไปได้ไหมที่แพทย์เท่านั้นที่ตัดสินใจ!
- เป็นไปได้หรือไม่ที่จะใช้ยาพาราเซตามอลกับหญิงตั้งครรภ์รวมถึงในระยะแรกด้วย?
- ตัวชี้วัด HCG สำหรับการตั้งครรภ์นอกมดลูก
- อนุญาตให้ใช้ยาพาราเซตามอลในระหว่างตั้งครรภ์หรือไม่?
- “เหตุใดฉันจึงควรรับราชการในกองทัพ”: บทพูดคนเดียวที่ตรงไปตรงมากับตัวเอง ทำไมทุกคนจึงควรรับราชการในกองทัพ
- vus คืออะไรใน ID ทหารและการถอดรหัส
- หน้าอับอายของประวัติศาสตร์รัสเซีย: อัฟกานิสถาน
บทความยอดนิยม
- โรงเรียนสั่งการทหารชั้นสูงโนโวซีบีร์สค์ (โนโวซีบีสค์)
- ผู้ว่าการเซวาสโทพอล Sergei Kunitsyn: “ เรากลับมาจากสงครามอย่างไม่เกรงกลัว” Nikolai Semenovich Patolichev
- เจ้าหน้าที่ข่าวกรองในตำนาน Alexey Botyan ชีวประวัติของเจ้าหน้าที่ข่าวกรอง Alexander Batyan
- สวดมนต์หางานหางาน
- คำอธิษฐานของ Cyprian นั้นสั้น คำอธิษฐานของ Cyprian เพื่อห้ามปราม;
- คำอธิษฐานเพื่อความอยู่ดีมีสุขทางวัตถุ: จะอธิษฐานกับใคร?
- คำอธิษฐานหน้าไอคอน "กำแพงที่ไม่มีวันแตกหัก"
- วิธีกำจัดความเสียหายออกจากตัวคุณเอง
- วิธีลบความเสียหายจาก Volt ด้วยตัวเอง
- คำอธิษฐานเพื่อซื้อที่อยู่อาศัย บ้าน หรืออพาร์ตเมนต์


