Tizimning muvozanat konstantasini hisoblash. Kimyoviy muvozanat. kimyoviy muvozanat konstantasi
135-topshiriq.
Bir jinsli sistema uchun muvozanat konstantasini hisoblang
agar reaksiyaga kirishuvchi moddalarning muvozanat konsentratsiyasi (mol/l):
[SD] P = 0,004; [H 2 O] P = 0,064; [CO 2 ] P = 0,016; [H 2 ] p = 0,016,
Suv va CO ning dastlabki kontsentratsiyasi qanday? Javob: K = 1; ref = 0,08 mol/l; [CO]ref=0,02 mol/l.
Yechim:
Reaktsiya tenglamasi:
CO (g) + H 2 O (g) CO 2 (g) + H2 (g)
Ushbu reaksiya uchun tenglama konstantasi quyidagi ifodaga ega:
H 2 O va CO moddalarining dastlabki konsentrasiyalarini topish uchun reaksiya tenglamasiga ko ra 1 mol CO va 1 mol H 2 O dan 1 mol CO 2 va 1 mol H 2 hosil bo lishini hisobga olamiz. Muammoning shartlariga ko'ra, tizimning har bir litrida 0,016 mol CO 2 va 0,016 mol H 2 hosil bo'lganligi sababli, 0,016 mol CO va H 2 O iste'mol qilingan, shuning uchun kerakli dastlabki konsentratsiyalar tengdir:
Chiqish = [H 2 O] P + 0,016 = 0,004 + 0,016 = 0,02 mol / l;
[CO] chiqib = [CO] P + 0,016 = 0,064 + 0,016 = 0,08 mol/l.
Javob: Kp = 1;
ref = 0,08 mol/l; [CO] ref=0,02 mol/l.
136-topshiriq.
Bir jinsli sistemaning muvozanat konstantasi
ma'lum bir haroratda 1 ga teng bo'ladi. Agar dastlabki konsentratsiyalar teng bo'lsa (mol/l) barcha reaksiyaga kirishuvchi moddalarning muvozanat konsentrasiyalarini hisoblang: [CO] out = 0,10; [H 2 O] tashqariga = 0,40.
Javob: [CO 2 ] P = [H 2 ] P = 0,08; [CO] P = 0,02; [H 2 O] P = 0,32.
Reaktsiya tenglamasi:
Yechim:
CO (g) + H 2 O (g) CO 2 (g) + H 2 (g)

Muvozanat holatida to‘g‘ri va teskari reaksiyalar tezligi teng bo‘ladi va bu tezliklar konstantalarining nisbati doimiy bo‘lib, berilgan sistemaning muvozanat konstantasi deyiladi:
Reaksiya mahsulotlaridan birining muvozanat konsentratsiyasini x mol/l bilan belgilaymiz, u holda ikkinchisining muvozanat konsentratsiyasi ham x mol/l bo'ladi, chunki ularning ikkalasi ham bir xil miqdorda hosil bo'ladi. Boshlang'ich moddalarning muvozanat konsentratsiyasi quyidagicha bo'ladi:
[CO] ref = 0,10 – x mol/l; [H 2 O] ref = 0,40 - x mol/l. (chunki reaksiya mahsulotining x mol/l hosil bo‘lishi uchun mos ravishda x mol/l CO va H 2 O sarflanadi. Muvozanat holatida barcha moddalarning konsentratsiyasi (mol/l) bo‘ladi: [ CO 2 ] P = [H 2 ] P = x [CO] P = 0,10 - [H 2 O] P = 0,4 – x;
![]()
Biz ushbu qiymatlarni muvozanat konstantasi ifodasiga almashtiramiz:
Tenglamani yechib, x = 0,08 ni topamiz. Demak, muvozanat konsentratsiyasi (mol/l):
[H 2 O] P = 0,4 - x = 0,4 - 0,08 = 0,32 mol / l;
[CO] P = 0,10 - x = 0,10 - 0,08 = 0,02 mol / l.
137-topshiriq.
N 2 + ZN 2 = 2NH 3 bir jinsli sistemaning ma'lum bir haroratdagi muvozanat konstantasi 0,1 ga teng. Vodorod va ammiakning muvozanat konsentratsiyasi mos ravishda 0,2 va 0,08 mol/l ni tashkil qiladi. Muvozanat va azotning dastlabki kontsentratsiyasini hisoblang. Javob: P = 8 mol/l;
Yechim:
Reaktsiya tenglamasi:
ref = 8,04 mol/l.
N 2 + ZN 2 = 2NH 3

N2 ning muvozanat konsentratsiyasini x mol/l bilan belgilaymiz. Ushbu reaksiyaning muvozanat konstantasining ifodasi quyidagi shaklga ega:

Masala ma’lumotlarini muvozanat konstantasi ifodasiga almashtiramiz va N 2 konsentratsiyani topamiz. . N2 ning boshlang'ich konsentratsiyasini topish uchun biz reaksiya tenglamasiga ko'ra, 1 mol NH3 hosil bo'lishi uchun ½ mol N2 kerakligini hisobga olamiz. Chunki, masalaning shartlariga ko'ra, tizimning har bir litrida 0,08 mol NH 3, keyin 0,08 hosil bo'lgan.
1/2 = 0,04 mol N 2. Shunday qilib, N 2 ning kerakli boshlang'ich konsentratsiyasi quyidagilarga teng:
Javob: Ref = P + 0,04 = 8 + 0,04 = 8,04 mol/l.
P = 8 mol/l;
ref = 8,04 mol/l.
138-topshiriq
Javob: [CO 2 ] P = [H 2 ] P = 0,08; [CO] P = 0,02; [H 2 O] P = 0,32.
Muayyan haroratda bir jinsli tizimning muvozanati
2NO + O 2 ↔ 2NO 2 reaksiyaga kirishuvchi moddalarning quyidagi konsentratsiyasida (mol/l) o'rnatildi: p = 0,2; [O 2 ] p = 0,1;

p = 0,1. NO va O 2 ning muvozanat konstantasini va dastlabki konsentratsiyasini hisoblang. Javob: K = 2,5;
ref = 0,3 mol/l; [O 2 ] x = 0,15 mol/l ga teng.
Reaktsiya tenglamasi:
Javob: 2NO + O 2 ↔ 2NO 2
NO va O 2 ning boshlang’ich konsentrasiyalarini topish uchun reaksiya tenglamasiga ko’ra 2 mol NO va 1 mol O2 dan 2 mol NO 2 hosil bo’lishini, keyin 0,1 mol NO va 0,05 mol O 2 sarflanganligini hisobga olamiz. Shunday qilib, NO va O 2 ning dastlabki kontsentratsiyasi teng:
Ref = NO] p + 0,1 = 0,2 + 0,1 = 0,3 mol/l;
[O 2 ] tashqariga = [O 2 ] p + 0,05 = 0,1 + 0,05 = 0,15 mol / l.
Javob: [CO 2 ] P = [H 2 ] P = 0,08; [CO] P = 0,02; [H 2 O] P = 0,32.
Kp = 2,5;
ref = 0,3 mol/l; [O 2 ] ref = 0,15 mol/l.
Reaktsiya tenglamasidan kelib chiqadiki, reaktsiya tizimdagi hajmning pasayishi bilan boradi (4 mol gazsimon moddalardan 2 mol gazsimon moddalar hosil bo'ladi). Shuning uchun, tizimdagi bosim o'zgarganda, muvozanatning siljishi kuzatiladi. Agar siz ushbu tizimdagi bosimni oshirsangiz, u holda Le Chatelier printsipiga ko'ra, muvozanat o'ngga, hajmning pasayishi tomon siljiydi. Tizimdagi muvozanat o'ngga siljiganida, to'g'ridan-to'g'ri reaktsiya tezligi teskari reaktsiya tezligidan katta bo'ladi:
pr > arr yoki pr = k 3 > o br = k 2.
Agar tizimdagi bosim kamaytirilsa, u holda tizimning muvozanati chapga, hajmning oshishi tomon siljiydi, keyin muvozanat chapga siljiganida, oldinga siljish reaktsiyasi tezligidan kamroq bo'ladi. oldinga reaktsiya:
pr< обр или (пр = k 3 )< (обр = k 2).
b) reaksiya tenglamasi:
N2 + O2) ↔ 2NO. .
Reaksiya tenglamasidan kelib chiqadiki, reaktsiya sodir bo'lganda, u hajmning o'zgarishi bilan birga bo'lmaydi, reaktsiya gazsimon moddalarning mollari soni o'zgarmasdan davom etadi; Shunday qilib, tizimdagi bosimning o'zgarishi muvozanatning o'zgarishiga olib kelmaydi, shuning uchun oldinga va teskari reaktsiyalarning tezligi teng bo'ladi:
pr = arr = yoki (pr k [O 2 ]) = (arr = k 2) .
140-topshiriq.
Bir hil tizimda tashqaridagi va [C1 2 ] ning dastlabki konsentratsiyasi
2NO + Cl 2 ↔ 2NOS1 mos ravishda 0,5 va 0,2 mol/l ni tashkil qiladi. Muvozanat yuzaga kelgan vaqtgacha 20% NO reaksiyaga kirsa, muvozanat konstantasini hisoblang. Javob: 0,417.
Yechim:
Reaksiya tenglamasi: 2NO + Cl 2 ↔ 2NOS1
Muammoning shartlariga ko'ra, reaktsiyaga 20% NO kirdi, bu 0,5 ni tashkil qiladi .
0,2 = 0,1 mol, 0,5 - 0,1 = 0,4 mol NO reaksiyaga kirishmadi. Reaksiya tenglamasidan kelib chiqadiki, har 2 mol NO uchun 1 mol Cl2 sarflanadi va 2 mol NOCl hosil bo'ladi. Binobarin, 0,1 mol NO bilan 0,05 mol Cl 2 reaksiyaga kirishdi va 0,1 mol NOCl hosil bo'ldi. 0,15 mol Cl 2 ishlatilmay qoldi (0,2 - 0,05 = 0,15). Shunday qilib, ishtirok etuvchi moddalarning muvozanat konsentratsiyasi teng (mol / l):
P = 0,4;
p = 0,15;
![]()
p = 0,1.
Ushbu ifodaga moddalarning muvozanat konsentratsiyasini almashtirib, biz hosil qilamiz.
ru. 298 K, 273 K va 373 K standart haroratlarda azot dioksidi 2NO 2 (g) = N 2 O 4 (g) ning dimerlanish reaktsiyasida Gibbs energiyasining DG o'zgarishini hisoblang. Jarayonning yo'nalishi haqida xulosa chiqaring. . Yuqoridagi haroratlarda azot dioksidining dimerlanish reaksiyasining muvozanat konstantalarini aniqlang. D G = 0 bo'lgan haroratni aniqlang. Bu reaktsiyaning bu haroratdan yuqori va pastdagi yo'nalishi haqida xulosa chiqaring. Komponentlarning termodinamik xususiyatlari:
D° 298 S o 298
Miqdori kJ/mol J/mol*K
NO 2 (g) 33,3 240,2
N 2 O 4 (g) 9,6 303,8
Yechim. Qaytariladigan jarayon uchun:
aA (g) + bB (g) ⇄ cC (g) + dD (g)
muvozanat konstantasi K p ifodasi bo'ladi
K r =(P c C *P d D)/(P a A *P b B)
bu yerda P A, P B, P C, P D - gazsimonning muvozanat qisman bosimlari A, B, C, D komponentlari a, b, c, d - stexiometrik koeffitsientlar.
aA (g) +bB jarayoni uchun (va) ⇄ s C(g) muvozanat konstantasining +dD (g) ifodasi
K c = (C c C *C d D)/(C a A *C b B)
bu yerda C A, C B, C C, C D muvozanat konsentrasiyalari moddalar A, B, C, D a, b, c, d - stexiometrik koeffitsientlar.
2NO 2 ⇄ N 2 O 4 tizimi uchun (1.4.1) formulaga muvofiq bizda
K r =P N 2 O 4 /P 2 NO 2
298 K standart haroratda entalpiyaning o'zgarishi (reaksiyaning DH o) formulasi (1.2.2) bo'yicha aniqlanadi.
DH o reaksiya = DD° 298 N 2 O 4 - 2D° 298 NO 2 = 9,6-2*33,5 = -57400 J.
Entropiya o'zgarishi (1.3.5)
DS o reaksiya = S° 298 N2O4 - 2S° 298 NO2 =303,8-2* (240,2)=-176 J/mol*K
Le Shatelier printsipidan foydalanib, teskari reaktsiya muvozanatda bo'lgan shartlar o'zgarganda, muvozanat o'zgarishning zaiflashuv jarayoniga siljiydi, biz muvozanat siljish yo'nalishini taxmin qilamiz. D o ning qiymati manfiy, shuning uchun hosil bo'lish reaktsiyasi ekzotermik (issiqlik chiqishi bilan davom etadi) va haroratning pasayishi bilan muvozanat o'ngga, haroratning oshishi bilan esa chapga siljishi kerak. Bundan tashqari, (1.3.6) formula bo'yicha, DH ekanligini bilib
DG o 273; DG o 298; DG o 373 va K 273; K298; K 373
Berilgan haroratlar uchun Gibbs energiya qiymatini (1.3.7) formuladan foydalanib hisoblaymiz:
DG o 298 =DH o -TODS o =-57400-298*(-176)=-4952J.,
DG o 273 =-57400-273*(-176)=-9352J:
DG o 373 =-57400-373*(-176)= 7129 J.
DG o 298 ning manfiy qiymati reaksiya muvozanatining o‘ngga siljishini, DG o 273 ning kattaroq manfiy qiymati haroratning (298 dan 273 K gacha) pasayishi bilan muvozanatning o‘ngga siljishini ko‘rsatadi.
Ijobiy qiymat DG o 373 o'z-o'zidan sodir bo'ladigan jarayon yo'nalishining o'zgarishini ko'rsatadi. Bu haroratda teskari reaktsiya (muvozanatning chapga siljishi) afzalroq bo'ladi.
Muvozanat konstantalari K p va Gibbs energiyasi DG o formula bilan bog’langan
bu yerda K p - jarayonning muvozanat konstantasi; R - gaz doimiysi; T - mutlaq harorat. (1.4.3) formulaga muvofiq bizda:
lnK 273 =- DG o 273 /RT=9352/8,31*273=4,12
lnK 298 = -DG o 298 /RT=4952/8,31*298=2
lnK 373 = -DG o 373 /RT=-7129/8,31*298=-2,3
K 298 va K 273 > 1 qiymati muvozanatning o'ngga siljishini bildiradi ((1.4.1) bilan solishtiring) va muvozanat konstantasining qiymati qanchalik katta bo'lsa, shuncha katta bo'ladi. K 373< 1, говорит ο смещении равновесия в системе влево (сравни с (1.4.1)).
DG o reaksiya =0 sharti muvozanat konstantasiga mos keladi,
birga teng.
(1.3.7) formuladan foydalanib, ushbu konstantaga mos keladigan harorat T ni hisoblaymiz:
DG°=DD°-TODS o ; O=DH o -TODS o ;
T D G =0 =DE°/DS°=57400/176=326,19 K
Xulosa. 326,19 K haroratda to'g'ri va teskari reaksiyalar teng ehtimollik bilan sodir bo'ladi, K p =1. Harorat pasayganda, muvozanat o'ngga siljiydi va chapga kuchayadi.
2-misol. N reaksiyaga muvofiq NH 3 ning sintez reaksiyasi uchun muvozanat konstantasi K p 2+3 623 K da H2==2NH 3 2,32*10 -13 ga teng. Xuddi shu haroratda Kc ni hisoblang.
Yechim. K p va K c o'rtasidagi munosabatlar formula bo'yicha amalga oshiriladi
K p = K c (RT) D n , (1.4.4)
Dn= n 2 - n 1 =2-4= -2, bunda n 1 va n 2 reaktivlar va mahsulotlarning mollari soni. Demak,
K c =K p /(RT) D n =0,624*10 -5
Javob. K = 0,624*10 -5.
2-misol. 1154 K da kaltsiy karbonat dissotsilanishning elastikligi 80380 Pa, 1164 K da esa 91177 Pa ga teng. Qaysi haroratda kaltsiy karbonat dissotsiatsiyasining elastikligi 101325 Pa ga teng bo'lishini hisoblang.
Yechim. Dissotsilanish reaksiyasi CaCO 3 (cr) ⇄ CaO (cr) + CO 2 (g)
Bu yerdan (1.4.1) tomonidan
K p =P CO 2
Shunday qilib, har bir haroratda (T 1 - 1154 K; P = 1164 K* D = X) muvozanat konstantalari bosimga mos keladi:
K T 1 = 80380; K T 2 = 91177; K T 3 = 101325.
Muvozanat konstantasining haroratga bog'liqligi Arrenius tenglamasi bilan ko'rsatilgan
dlnK p /dT= DA/RT 2 (1.4.5)
bu yerda K p - muvozanat konstantasi; T - harorat, K; D - reaksiyaning issiqlik effekti; R - gaz doimiysi.
D H = const da T 1 -T 2 harorat oralig'ida (1.4.5) integrallash tenglamasini olamiz.
lnK T 1 /K T 2 = DD/R(1/T 1 -1/T 2),
Bu erda K T 1 va K T 2 - T 1 va T 2 da muvozanat konstantalari.
Avval D ni aniqlaymiz (1.4.6 ga muvofiq)
DD=ln(91177*8.31*1154*1164/80380*10)=140500 J/mol.
ln(101325/91177)=140500/8,31(1/1164-1/T 3)
T 3 =1172 K
Javob. T=1172K da kaltsiy karbonat dissotsiatsiyasining elastikligi 101325 Pa ga teng bo'ladi.
Vazifalar
56. Dissotsiatsiya konstantasi sirka kislotasi 298 K da 1,75*10 -5 ga teng. Sirka kislotaning dissotsilanishning Gibbs energiyasi qanday o'zgaradi?
57. BaSO 4 (cr) → Ba 2+ (p) + SO 2- 4 (p) reaksiyasi uchun Gibbs energiyasi (DG o 298) va K 298 muvozanat konstantasining qiymatini toping.
Hisoblash uchun quyidagi ma'lumotlardan foydalaning:
Modda S o 298 J/mol*K DH o 298 kJ/mol 2 ^ 2^
BaSO 4(cr) 132,4 -1447,39
Ba 2+ (p) 9,64 -533,83
SO 2- 4 (p) 18,44 -904,2.
58. Etilen gidratlanish reaksiyasi uchun 473 K da muvozanat konstantasini toping.
C 2 H 4 (g) + H 2 O (g) = C 2 H 5 OH (g).
Reaktivlarning xossalari jadvalda keltirilgan. 3. DS va DH ning haroratga bog'liqligini e'tiborsiz qoldiring.
59. Shuni hisobga olib DH o 298 Va DS taxminan 298 4HCl + O 2 ⇄ 2H 2 O + 2Cl 2 reaktsiyalari haroratga bog'liq emas, qaysi haroratni toping
K p =1, va DG o = HAQIDA.
60. Jadval ma’lumotlaridan foydalanib, 298 K va 1000 K da quyidagi reaksiyalarning muvozanat konstantalarini hisoblang:
a) H 2 O (g) + CO ⇄ CO 2 + H 2
b) CO 2 + C (gr) ⇄ 2CO;
c) N 2 + 3H 2 ⇄ 2NH 3.
Haroratga qarab DH o va S o o'zgarishlariga e'tibor bermang.
61. Ayrim spontan reaksiya uchun D S< О. Как будет изменяться константа равновесия с повышением температуры: а) увеличиваться, б) уменьшаться, в) по данным задачи нельзя определить.
62. Hisoblashlardan foydalanmasdan quyidagi jarayonlarning DS o belgisini belgilang:
a) 2NH 3 (g) ⇄ N 2 (g) + H 2 (g);
b) CO 2 (cr) ⇄ CO 2 (g);
c) 2NO (g) + O 2 (g) = 2NO 2 (g);
d) 2H 2 S (g) + 3O 2 = 2H 2 O (l) + 2SO 2 (g);
e) 2CH 3 OH (g) + 3O 2 (g) = 4H 2 O (g) + 2CO 2 (g).
63. Qaysisida quyidagi holatlar reaksiya har qanday haroratda mumkin: a) DH°< 0, ΔS°>0; b) D N°<0, ΔS°<0; в) Δ Н°>0, DS°> 0 ?
64. Quyidagi holatlarning qaysi birida reaksiya har qanday haroratda amalga oshirilmaydi: a) DN°> 0, DS°> 0; b) DN°>0, DS°<0; в) Δ Н°<0, ΔS°<0 ?
65. Agar D° bo'lsa<0 и ΔS°<0 ,
Qaysi hollarda reaksiya o'z-o'zidan borishi mumkin?
a)| DN°| > |TOS°|; b)| DN°| > |TOS°| ?
66. Tizimga qanday ta'sirlar tizimlar muvozanatini o'zgartirishi mumkin?
a) N 2 (g) + 3H 2 (g) ⇄ 2NH 3 (g);
b) 4Fe (cr) + 3O 2 (g) ⇄ 2Fe 2 O 3 (cr);
c) SO 2 (g) + O 2 (g) ⇄ 2SO 3 (g).
67. Tizimlarda harorat ko'tarilganda muvozanat qaysi tomonga siljiydi?
1) COCl 2 ⇄ CO +Cl 2; DN°=113 kJ;
2) 2CO ⇄ CO 2 + C; DN°=-171 kJ;
3) 2SO 3 ⇄ 2SO 2 + O 2; DN°=192 kJ.
68. Tizimlardagi bosim ortganda muvozanat qaysi tomonga siljiydi?
1) H 2 (g) + S (cr) ⇄ H 2 S (g);
2) 2CO (g) ⇄ CO 2 (g) + C (g);
3) 4HCl (g) + O 2 (g) ⇄ 2H 2 O (g) + 2Cl 2 (g).
69. Quyidagi reaksiyalar muvozanatiga qanday ta'sir qiladi?
CaCO 3 (cr) ⇄ CaO (cr) + CO 2 (g); DN°=178 kJ;
2CO (g) + O 2 (g) ⇄ 2CO 2; DN°=-566 kJ;
N 2 (g) + O 2 (g) ⇄ 2NO (g); DN°=180 kJ.
a) haroratning oshishi;
b) bosimning oshishi?
70. Malumot ma'lumotlaridan foydalanib, suv gazining hosil bo'lish reaksiyasining muvozanat konstantasi bo'lgan haroratning taxminiy qiymatini toping.
C (g) + H 2 O (g) ⇄ CO (g) + H 2 (g)
ga teng 1. DH o va S o ning haroratga bog'liqligini e'tiborsiz qoldiring.
71. 600 o C da CO + Cl 2 ⇄ COCl 2 reaksiyasining K p muvozanat konstantasi 1,67 * 10 -6 ga teng. Berilgan haroratdagi reaksiya uchun Kc ni hisoblang.
72. Magniy karbonatning 1000 K da dissotsilanish elastikligi 42189 Pa, 1020 K da 80313 Pa ga teng. MgCO 3 ⇄ MgO + CO 2 reaktsiyasining issiqlik effektini va magniy karbonat dissotsiatsiyasining elastikligi 1 Pa ga teng bo'lgan haroratni aniqlang.
Kimyoviy muvozanat - bu qaytariladigan kimyoviy reaksiya holati.
aA+ b B= c C+ d D,
bunda vaqt o'tishi bilan reaksiya aralashmasidagi reaktivlarning konsentratsiyasi o'zgarmaydi. Kimyoviy muvozanat holati xarakterlanadi kimyoviy muvozanat konstantasi:
Qayerda C i- tarkibiy qismlarning konsentratsiyasi muvozanat mukammal aralash.
Muvozanat konstantasini muvozanat mol kasrlari bilan ham ifodalash mumkin X i komponentlar:
Gaz fazasida sodir bo'ladigan reaktsiyalar uchun muvozanat konstantasini muvozanat qisman bosimlari bilan ifodalash qulaydir. P i komponentlar:
Ideal gazlar uchun P i = C va RT Va P i = X va P, Qayerda P umumiy bosim, shuning uchun K P, K C Va K X quyidagi munosabatlar bilan bog'liq:
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
Muvozanat konstantasi bilan bog'liq r G o kimyoviy reaksiya:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
O'zgartirish r G yoki r F berilgan (muvozanat shart emas) qisman bosimlarda kimyoviy reaksiyada P i yoki konsentratsiyalar C i Komponentlarni tenglama yordamida hisoblash mumkin kimyoviy reaksiya izotermlari (Van't-Xoff izotermlari):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Ga binoan Le Chatelier printsipi, Muvozanatdagi tizimga tashqi ta'sir o'tkazilsa, muvozanat tashqi ta'sirning ta'sirini kamaytiradigan tarzda siljiydi. Shunday qilib, bosimning oshishi muvozanatni gaz molekulalari sonining kamayishiga olib keladi. Muvozanat aralashmasiga har qanday reaksiya komponentini qo'shish muvozanatni ushbu komponent miqdorining kamayishiga olib keladi. Haroratning oshishi (yoki pasayishi) muvozanatni issiqlikning yutilishi (chiqishi) bilan sodir bo'ladigan reaktsiyaga siljitadi.
Muvozanat konstantasining haroratga miqdoriy bog'liqligi tenglama bilan tavsiflanadi kimyoviy reaksiya izobarlari (Vant Hoff izobarlari)
![]() (9.9)
(9.9)
Va kimyoviy reaksiya izoxoralari (Van't Xoff isoxores)
![]() . (9.10)
. (9.10)
(9.9) tenglamani faraz ostida integrallash r H reaktsiya haroratga bog'liq emas (bu tor harorat oralig'ida to'g'ri keladi), quyidagilarni beradi:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
Qayerda C - integratsiya konstantasi. Shunday qilib, qaramlik ln K 1 dan P /T chiziqli bo'lishi kerak va to'g'ri chiziqning qiyaligi - r H/R.
Ichkarida integratsiya K 1 , K 2, va T 1, T 2 beradi:
 (9.13)
(9.13)
 (9.14)
(9.14)
Ushbu tenglamadan foydalanib, ikki xil haroratdagi muvozanat konstantalarini bilib, biz hisoblashimiz mumkin r H reaktsiyalar. Shunga ko'ra, bilish r H reaksiya va muvozanat konstantasi bir haroratda, siz boshqa haroratda muvozanat konstantasini hisoblashingiz mumkin.
MISOLLAR
CO(g) + 2H 2 (g) = CH 3 OH (g)
500 K da. f G o CO (g) va CH 3 OH (g) uchun 500 K da -155,41 kJ ga teng. mol –1 va –134,20 kJ. mos ravishda mol -1.
Yechim. G o reaktsiyalar:
r G o= f G o(CH 3 OH) - f G o(CO) = -134,20 - (-155,41) = 21,21 kJ. mol –1.
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
9-2-misol. Reaktsiya muvozanat konstantasi
ga teng K 400 o S da P = 1,64 10 –4. N 2 va H 2 ning ekvimolyar aralashmasiga qanday umumiy bosim qo'llanilishi kerak, shunda N 2 ning 10% NH 3 ga aylanadi? Gazlar ideal deb hisoblanadi.
Yechim. Bir mol N 2 reaksiyaga kirishsin. Keyin
| N 2 (g) | + | 3H 2 (g) | = | 2NH 3 (g) | |
| Asl miqdor | 1 | 1 | |||
| Muvozanat miqdori | 1– | 1–3 | 2 (jami: 2–2) | ||
| Muvozanat mol ulushi: |
Demak, K X = 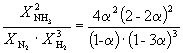 Va K P = K X. P –2
=
Va K P = K X. P –2
=  .
.
Olingan formulaga = 0,1 ni almashtirsak, biz bor
1.64 10 –4 = , qayerda P= 51,2 atm.
, qayerda P= 51,2 atm.
9-3-misol. Reaktsiya muvozanat konstantasi
CO(g) + 2H 2 (g) = CH 3 OH (g)
500 K da ga teng K P = 6,09 10 -3. 1 mol CO, 2 mol H 2 va 1 mol inert gaz (N 2) dan tashkil topgan reaksiya aralashmasi 500 K va umumiy bosim 100 atm ga qadar isitiladi. Muvozanat aralashmasining tarkibini hisoblang.
Yechim. Bir mol CO reaksiyaga kirishsin. Keyin
| CO(g) | + | 2H 2 (g) | = | CH3OH(g) | |
| Asl miqdori: | 1 | 2 | 0 | ||
| Muvozanat miqdori: | 1– | 2–2 | |||
| Muvozanat aralashmasidagi jami: | 3-2 mol komponentlar + 1 mol N 2 = 4-2 mol | ||||
| Muvozanat mol ulushi | |||||
Demak, K X =  Va K P = K X. P–2 =
Va K P = K X. P–2 = ![]() .
.
Shunday qilib, 6,09 10 –3 = ![]() .
.
Bu tenglamani yechib, = 0,732 ni olamiz. Shunga ko'ra, muvozanat aralashmasidagi moddalarning mol ulushlari teng: = 0,288, = 0,106, = 0,212 va = 0,394.
9-4-misol. Reaktsiya uchun
N 2 (g) + 3H 2 (g) = 2NH 3 (g)
298 K da K P = 6,0 10 5, a f H o(NH 3) = –46,1 kJ. mol –1. 500 K da muvozanat konstantasining qiymatini hisoblang.
Yechim. Reaksiyaning standart molyar entalpiyasi
r H o= 2f H o(NH 3) = –92,2 kJ. mol –1.
(9.14) tenglamaga muvofiq,  =
=
Ln (6,0 10 5) + ![]() = -1.73, qaerdan K 2 =
0.18.
= -1.73, qaerdan K 2 =
0.18.
E'tibor bering, ekzotermik reaksiyaning muvozanat konstantasi harorat oshishi bilan kamayadi, bu Le Shatelye printsipiga mos keladi.
VAZIFALAR
- Muvozanat aralashmasida 1273 K va umumiy bosim 30 atm
- 2000 o C va umumiy bosim 1 atm bo'lganda, suvning 2% vodorod va kislorodga ajraladi. Reaksiyaning muvozanat konstantasini hisoblang
- Reaktsiya muvozanat konstantasi
- Reaktsiya muvozanat konstantasi
- 1,79 10 -2 mol I 2 bo'lgan 3 litrli idish 973 K ga qizdirildi. Muvozanat holatidagi idishdagi bosim 0,49 atm bo'lib chiqdi. Gazlarni ideal deb hisoblab, reaksiya uchun 973 K da muvozanat konstantasini hisoblang
- Reaktsiya uchun
- Reaktsiya uchun
- 0,341 mol PCl 5 va 0,233 mol N 2 bo'lgan 1 litrli idish 250 o C ga qizdirildi. Muvozanat holatidagi idishdagi umumiy bosim 29,33 atm bo'lib chiqdi. Barcha gazlarni ideal deb hisoblab, idishda sodir bo'ladigan reaksiya uchun 250 o C da muvozanat konstantasini hisoblang.
- Reaktsiya muvozanat konstantasi
- 25 o C da f G o(NH 3) = –16,5 kJ. mol –1. r G Hisoblash
- N 2, H 2 va NH 3 ning qisman bosimida mos ravishda 3 atm, 1 atm va 4 atm ga teng NH 3 hosil bo'lish reaktsiyalari. Bu sharoitda reaksiya o'z-o'zidan qaysi yo'nalishda boradi?
- Borneolning (C 10 H 17 OH) izomerlanishining gaz fazali reaksiyasining muvozanat konstantasi 503 K da 0,106 ga teng. 5 litrli idishga 7,5 g borneol va 14,0 g izoborneol aralashmasi qo'yildi va saqlangan. muvozanatga erishilgunga qadar 503 K da.
- Muvozanat aralashmasidagi borneol va izoborneolning mol ulushlari va massalarini hisoblang.
- reaktsiya uchun. Qanday umumiy bosimda Cl 2 ning parsial bosimi 0,10 barga teng bo'ladi?
- 400 o C da teng
- Azotning parsial bosimi 0,9 atm bo'lishi uchun sistemaga N 2 qo'shilsa, PCl 5 ning dissotsilanish darajasi qanday bo'ladi?
- N 2 (g) + O 2 (g) = 2NO (g)
K p = 2,5 10 -3. - Umumiy bosim 1 bar bo'lgan N 2, O 2, NO va inert gazning muvozanat aralashmasi 80% (hajm bo'yicha) N 2 va 16% O 2 ni o'z ichiga oladi.
CO 2 (g) + C(tv) = 2CO(g)
17% (hajmi bo'yicha) CO 2 ni o'z ichiga oladi. Umumiy bosim 20 atm bo‘lganda gaz tarkibida CO 2 ning necha foizi bo‘ladi? Qanday bosimda gaz 25% CO 2 ni o'z ichiga oladi?
Bu sharoitlarda H 2 O (g) = H 2 (g) + 1/2O 2 (g).
CO(g) + H 2 O (g) = CO 2 (g) + H 2 (g)
500 o C da teng Kp= 5.5. 1 mol CO va 5 mol H 2 O dan iborat aralashma shu haroratgacha qizdirildi. Muvozanat aralashmasidagi H 2 O ning mol ulushini hisoblang.
N 2 O 4 (g) = 2NO 2 (g)
25 o C da teng Kp= 0,143. Ushbu haroratda 1 g N 2 O 4 qo'yilgan 1 litr hajmli idishda o'rnatiladigan bosimni hisoblang.
I 2 (g) = 2I (g).
250 o C da r G o = –2508 J mol –1. Qanday umumiy bosimda 250 o C da PCl 5 ning PCl 3 va Cl 2 ga aylanish darajasi 30% ni tashkil qiladi?
2HI(g) = H 2 (g) + I 2 (g)
muvozanat konstantasi K 698,6 K da P = 1,83 10 –2. Uch litrli idishda 10 g I 2 va 0,2 g H 2 shu haroratgacha qizdirilganda necha gramm HI hosil bo‘ladi? H 2, I 2 va HI ning parsial bosimlari qanday?
PCl 5 (g) = PCl 3 (g) + Cl 2 (g)
CO(g) + 2H 2 (g) = CH 3 OH (g)
500 K da ga teng K P = 6,09 10 -3. Agar CO va H2 1:2 nisbatda olinadigan bo'lsa, 90% hosilda metanol ishlab chiqarish uchun zarur bo'lgan umumiy bosimni hisoblang.
CO(g) + 2H 2 (g) = CH 3 OH (g)
Ekzotermik reaksiya T 500 K va 10 barda muvozanatda. Agar gazlar ideal bo'lsa, metanol unumiga quyidagi omillar qanday ta'sir qiladi: a) ortadi P; b) rag'batlantirish ; c) at inert gaz qo'shish V P= const; P d) at inert gaz qo'shish
Reaksiyadagi muvozanat
2NOCl(g) = 2NO(g) + Cl 2 (g) r G o NOCl ning qisman bosimi 0,64 bar bo'lganda (dastlab faqat NOCl mavjud edi) 227 o C va umumiy bosim 1,0 barga o'rnatiladi. Hisoblash
N 2 (g) + 3H 2 (g) = 2NH 3 (g)
400 o S da hajmi bo‘yicha 10% NH 3 ni o‘z ichiga olgan muvozanat aralashmasini olish uchun 3 qism H 2 va 1 qism N 2 aralashmasiga qo‘llanilishi kerak bo‘lgan umumiy bosimni hisoblang. Reaksiya uchun muvozanat konstantasi. K = 1.60 10 –4 .
250 o C va umumiy bosim 1 atm da PCl 5 reaksiya natijasida 80% dissotsilanadi.
PCl 5 (g) = PCl 3 (g) + Cl 2 (g).
Umumiy bosim 1 atm darajasida saqlanadi.
Reaksiya uchun 2000 o C da
Hajmi bo'yicha necha foiz YO'Q? Inert gazning parsial bosimi qanday? K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Muvozanat konstantasi bo'lgan reaksiyaning standart entalpiyasini hisoblang
a) 2 marta ortadi, b) harorat 298 K dan 308 K gacha o'zgarganda 2 marta kamayadi.
2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) reaktsiyasining muvozanat konstantasining 300 K dan 600 K gacha bo'lgan haroratga bog'liqligi tenglama bilan tavsiflanadi.
ln
O'quv savollari
a) 2 marta ortadi, b) harorat 298 K dan 308 K gacha o'zgarganda 2 marta kamayadi.
Balans holati.
Muvozanat konstantasi
Muvozanat konsentrasiyalarini hisoblash
 Kimyoviy muvozanatning o'zgarishi. Le Chatelier printsipi Xuddi shu sharoitda bir vaqtning o'zida qarama-qarshi yo'nalishda sodir bo'ladigan reaktsiyalar qaytariladigan deyiladi. Yopiq tizimda sodir bo'ladigan teskari reaktsiyani ko'rib chiqing
Kimyoviy muvozanatning o'zgarishi. Le Chatelier printsipi Xuddi shu sharoitda bir vaqtning o'zida qarama-qarshi yo'nalishda sodir bo'ladigan reaktsiyalar qaytariladigan deyiladi. Yopiq tizimda sodir bo'ladigan teskari reaktsiyani ko'rib chiqing
To'g'ridan-to'g'ri reaktsiya tezligi tenglama bilan tavsiflanadi:  pr =
pr =
Xuddi shu sharoitda bir vaqtning o'zida qarama-qarshi yo'nalishda sodir bo'ladigan reaktsiyalar qaytariladigan deyiladi. k
pr [A] [B], Qayerda pr – bevosita reaksiya tezligi; pr - to'g'ridan-to'g'ri reaktsiyaning tezlik konstantasi. Vaqt o'tishi bilan reaktivlarning konsentratsiyasi  A
A
Va Qayerda pr – bevosita reaksiya tezligi; pr - to'g'ridan-to'g'ri reaktsiyaning tezlik konstantasi. IN C pr – bevosita reaksiya tezligi; pasayadi, reaktsiya tezligi pasayadi (1-rasm, egri pr). Qayerda pr – bevosita reaksiya tezligi; pr - to'g'ridan-to'g'ri reaktsiyaning tezlik konstantasi..
O'rtasidagi reaktsiya
 moddalar hosil bo`lishiga olib keladi Xuddi shu sharoitda bir vaqtning o'zida qarama-qarshi yo'nalishda sodir bo'ladigan reaktsiyalar qaytariladigan deyiladi.
D
moddalar hosil bo`lishiga olib keladi Xuddi shu sharoitda bir vaqtning o'zida qarama-qarshi yo'nalishda sodir bo'ladigan reaktsiyalar qaytariladigan deyiladi.
D
To'g'ridan-to'g'ri reaktsiya tezligi tenglama bilan tavsiflanadi:  rev – teskari reaksiya tezligi;
rev – teskari reaksiya tezligi;
Xuddi shu sharoitda bir vaqtning o'zida qarama-qarshi yo'nalishda sodir bo'ladigan reaktsiyalar qaytariladigan deyiladi. rev – teskari reaksiya tezligi konstantasi.
Moddalarning kontsentratsiyasi sifatida C pr – bevosita reaksiya tezligi; pasayadi, reaktsiya tezligi pasayadi (1-rasm, egri ortishi, teskari reaksiya tezligi ortadi (1-rasm, egri chiziq  arr).
arr).

1-rasm. Vaqt o'tishi bilan oldinga va teskari reaktsiyalar tezligining o'zgarishi
Birozdan so'ng To'g'ridan-to'g'ri va teskari reaktsiyalarning tezligi teng bo'ladi:
 pr =
pr =  arr.
arr.
Tizimning bu holati deyiladi muvozanat holati .
Muvozanat holatida uning barcha ishtirokchilarining kontsentratsiyasi vaqt o'tishi bilan o'zgarishni to'xtatadi . Bunday konsentratsiyalar deyiladi muvozanat .
Kimyoviy muvozanat – Bu dinamik muvozanat. Yopiq tizimda mavjud bo'lgan moddalar kontsentratsiyasining o'zgarmasligi doimiy davom etadigan kimyoviy jarayonlarning natijasidir. To'g'ri va teskari reaktsiyalarning tezligi nolga teng emas, lekin jarayonning kuzatilgan tezligi nolga teng.
To'g'ridan-to'g'ri va teskari reaktsiyalar tezligining tengligi kimyoviy muvozanatning kinetik shartidir.
2. Muvozanat konstantasi
To'g'ri va teskari reaktsiyalarning tezligi teng bo'lganda
 pr =
pr =  arr.
arr.
tenglik haqiqatdir
Xuddi shu sharoitda bir vaqtning o'zida qarama-qarshi yo'nalishda sodir bo'ladigan reaktsiyalar qaytariladigan deyiladi. pr [A] [B] = Xuddi shu sharoitda bir vaqtning o'zida qarama-qarshi yo'nalishda sodir bo'ladigan reaktsiyalar qaytariladigan deyiladi. arr [C] [D],
Qayerda [ A], [B], [BILAN], [pasayadi, reaktsiya tezligi pasayadi (1-rasm, egri] – moddalarning muvozanat konsentratsiyasi.
Tezlik konstantalari konsentratsiyalarga bog'liq emasligi sababli, tenglikni boshqacha yozish mumkin:

To'g'ridan-to'g'ri va teskari reaktsiyalar tezligi konstantalarining nisbati ( Xuddi shu sharoitda bir vaqtning o'zida qarama-qarshi yo'nalishda sodir bo'ladigan reaktsiyalar qaytariladigan deyiladi. pr / Xuddi shu sharoitda bir vaqtning o'zida qarama-qarshi yo'nalishda sodir bo'ladigan reaktsiyalar qaytariladigan deyiladi. arr. ) kimyoviy muvozanat konstantasi deyiladi:
|
|
Haqiqiy kimyoviy muvozanat reaksiya mexanizmining barcha elementar bosqichlari muvozanatda bo'lgandagina o'rnatilishi mumkin. To'g'ridan-to'g'ri va teskari reaktsiyalarning mexanizmlari qanchalik murakkab bo'lmasin, muvozanat holatida ular boshlang'ich moddalarning reaktsiya mahsulotlariga va orqaga stexiometrik o'tishini ta'minlashi kerak. Bu jarayonning barcha bosqichlarining algebraik yig'indisi reaktsiyaning stokiometrik tenglamasiga teng ekanligini anglatadi, ya'ni. stoxiometrik koeffitsientlar mexanizmning barcha bosqichlarining molekulyarliklari yig'indisini ifodalaydi.
Murakkab reaktsiya uchun
aA + bB cC + dD
|
K s = |
Xuddi shu harorat uchun stexiometrik koeffitsientlarga teng darajalardagi reaktsiya mahsulotlarining muvozanat konsentrasiyalari mahsulotining stexiometrik koeffitsientlarga teng darajalarda boshlang'ich moddalarning muvozanat konsentrasiyalari mahsulotiga nisbati doimiy qiymatdir..
Bu ommaviy harakatlar qonunining ikkinchi formulasi.
Geterogen reaktsiyaning muvozanat konstantasi ifodasi faqat suyuqlik yoki gazsimon fazadagi moddalar konsentratsiyasini o'z ichiga oladi, chunki qattiq moddalarning konsentratsiyasi, qoida tariqasida, doimiy bo'lib qoladi.
Masalan, quyidagi reaksiyaning muvozanat konstantasining ifodasi
CO 2 (g) + C (tv) 2 CO (g)
shunday yozilgan:
TO c =  .
.
Muvozanat konstantasi tenglamasi shuni ko'rsatadiki, muvozanat sharoitida reaksiyada ishtirok etuvchi barcha moddalarning kontsentratsiyasi bir-biriga bog'liqdir. Muvozanat konstantasining raqamli qiymati barcha reaksiyaga kirishuvchi moddalar konsentratsiyasining muvozanat holatida qanday bo'lishi kerakligini aniqlaydi.
Ushbu moddalarning har qandayining kontsentratsiyasining o'zgarishi barcha boshqa moddalarning kontsentratsiyasining o'zgarishiga olib keladi. Natijada, yangi konsentratsiyalar o'rnatiladi, lekin ular orasidagi munosabatlar yana muvozanat konstantasiga mos keladi.
Muvozanat konstantasining qiymati ga bog'liq reaktivlarning tabiati va harorat.
Reaktivlarning molyar kontsentratsiyasi bilan ifodalangan muvozanat konstantasi ( TOBilan) va muvozanatning qisman bosimlari bilan ifodalangan muvozanat konstantasi ( TOr) (qarang: “Kimyoviy termodinamika asoslari”) quyidagi munosabatlar bilan oʻzaro bogʻlangan:
TOr= KBilanRT , Kc = Kr / (RT) ,
bu yerda - reaksiyadagi gazsimon mollar sonining o'zgarishi.
Gibbs energiyasining standart o'zgarishi
G T = - RT ln Kp,
G T = H – T S.
Tenglamalarning o'ng tomonlarini tenglashtirgandan so'ng:
- RT ln Kp = H – T S
ln K r = - H / ( RT) + S/ R .
Tenglama nafaqat konstantaning haroratga bog'liqlik turini belgilaydi, balki konstanta reaksiyaga kirishuvchi moddalarning tabiati bilan aniqlanishini ham ko'rsatadi.
Muvozanat konstantasi konsentratsiyalarga (reaksiya tezligi konstantasi kabi), reaksiya mexanizmiga, faollanish energiyasiga yoki katalizatorlar mavjudligiga bog‘liq emas.. Mexanizmni o'zgartirish, masalan, katalizatorni kiritishda, muvozanat konstantasining raqamli qiymatiga ta'sir qilmaydi, lekin, albatta, muvozanat holatiga erishish tezligini o'zgartiradi.
Kimyoviy muvozanat konstantasi
Kimyoviy muvozanatning miqdoriy xarakteristikasi hisoblanadi muvozanat konstantasi , bu muvozanat konsentrasiyalari C i, qisman bosimlari P i yoki reaktivlarning mol fraktsiyalari X i bilan ifodalanishi mumkin. Ba'zi reaktsiya uchun
mos keladigan muvozanat konstantalari quyidagicha ifodalanadi:



Muvozanat konstantasi har bir qaytariladigan kimyoviy reaksiya uchun xarakterli qiymatdir; muvozanat konstantasining qiymati faqat reaktivlarning tabiatiga va haroratga bog'liq. P i = C i RT munosabati sifatida yozilgan ideal gazning holat tenglamasiga asoslanib, bu erda C i = n i /V va ideal gaz aralashmasi uchun Dalton qonuni P = SP i tenglama bilan ifodalanadi. Pi qisman bosimi, C i molyar kontsentratsiyasi va i-komponentning X i mol ulushi o'rtasidagi munosabatni olish mumkin:
![]()
Bu erdan biz K c, K p va K x o'rtasidagi munosabatni olamiz:
![]()
Bu erda D - reaksiya jarayonida gazsimon moddalar mollari sonining o'zgarishi:
D = – n 1 – n 2 – ... + n" 1 + n" 2 + ...
K x muvozanat konstantasining qiymati K c va K p muvozanat konstantalaridan farqli o'laroq, umumiy bosim P ga bog'liq.
Elementar qaytar reaksiyaning muvozanat konstantasi ifodasini kinetik tushunchalardan olish mumkin. Keling, vaqtning boshlang'ich momentida faqat boshlang'ich moddalar mavjud bo'lgan tizimda muvozanatni o'rnatish jarayonini ko'rib chiqaylik. Hozirgi vaqtda V 1 to'g'ridan-to'g'ri reaktsiya tezligi maksimal, V 2 teskari reaktsiyaning tezligi nolga teng:
![]()
![]()
Boshlang'ich moddalarning konsentratsiyasi kamayishi bilan reaksiya mahsulotlarining konsentratsiyasi oshadi; Shunga ko'ra, to'g'ridan-to'g'ri reaktsiya tezligi pasayadi, teskari reaktsiya tezligi ortadi. Ko'rinib turibdiki, bir muncha vaqt o'tgach, to'g'ridan-to'g'ri va teskari reaktsiyalarning tezligi tenglashadi, shundan so'ng reaksiyaga kirishuvchi moddalarning konsentratsiyasi o'zgarishni to'xtatadi, ya'ni. kimyoviy muvozanat o'rnatiladi.
V 1 = V 2 deb faraz qilib, yozishimiz mumkin:

Shunday qilib, muvozanat konstantasi to'g'ridan-to'g'ri va teskari reaktsiyalar tezligi konstantalarining nisbati hisoblanadi. Bu muvozanat konstantasining fizik ma'nosini bildiradi: u to'g'ridan-to'g'ri reaktsiya tezligi ma'lum bir haroratda teskari reaktsiya tezligidan necha marta katta ekanligini va barcha reaksiyaga kirishuvchi moddalarning konsentratsiyasi 1 mol / l ga teng ekanligini ko'rsatadi. Muvozanat konstantasi ifodasining yuqoridagi hosilasi, ammo kimyoviy reaksiya tezligi stexiometrik koeffitsientlarga teng kuchlarda qabul qilingan reaksiyaga kirishuvchi moddalar kontsentratsiyasining mahsulotiga to'g'ridan-to'g'ri proportsional degan umumiy noto'g'ri asosga asoslanadi. Ma'lumki, umumiy holatda kimyoviy reaksiyaning kinetik tenglamasidagi reagentlar konsentratsiyasidagi ko'rsatkichlar stexiometrik koeffitsientlarga to'g'ri kelmaydi.
11. Oksidlanish-qaytarilish reaksiyalari: ta’rifi, asosiy tushunchalari, oksidlanish va qaytarilishning mohiyati, reaksiyaning eng muhim oksidlovchi va qaytaruvchi moddalari.
Redoks deyiladi elektronlarning bir erkin yoki bog'langan atomdan ikkinchisiga siljishi bilan kechadigan jarayonlar. Bunday hollarda siljish darajasi emas, balki faqat joy almashgan elektronlar soni muhim bo'lganligi sababli, an'anaviy ravishda siljishni har doim to'liq deb hisoblash va elektronlarning orqaga qaytishi yoki siljishi haqida gapirish odatiy holdir.
Agar elementning atomi yoki ioni elektronlar bersa yoki qabul qilsa, birinchi holatda elementning oksidlanish darajasi oshadi va u oksidlangan shaklga (OR) o'tadi, ikkinchi holatda esa u kamayadi va element ketadi. qisqartirilgan shaklga (RF). Ikkala shakl ham konjugat redoks juftligini hosil qiladi. Har bir redoks reaktsiyasi ikkita konjugat juftligini o'z ichiga oladi. Ulardan biri elektronlarni qaytarilgan shaklga (OP 1 → VF 1) qabul qiluvchi oksidlovchi moddaning o'tishiga, ikkinchisi esa elektronlarni beruvchi qaytaruvchining oksidlangan shaklga (VF 2 → OF 2) o'tishiga mos keladi. ), masalan:
Cl 2 + 2 I – → 2 Cl – + I 2
OF 1 VF 1 VF 2 OF 2
(bu erda Cl 2 - oksidlovchi, I - qaytaruvchi)
Shunday qilib, bir xil reaksiya har doim ham qaytaruvchining oksidlanish jarayoni, ham oksidlovchining qaytarilish jarayonidir.
Oksidlanish-qaytarilish reaksiyalari tenglamalarida koeffitsientlarni topish mumkin elektron balans usullari va elektron-ion muvozanati. Birinchi holda, qabul qilingan yoki berilgan elektronlar soni elementlarning boshlang'ich va oxirgi holatlardagi oksidlanish darajalaridagi farq bilan aniqlanadi. Misol:
HN 5+ O 3 + H 2 S 2– → N 2+ O + S + H 2 O
Ushbu reaksiyada ikkita element oksidlanish darajasini o'zgartiradi: azot va oltingugurt. Elektron balans tenglamalari:
Dissotsilangan H 2 S molekulalarining ulushi ahamiyatsiz, shuning uchun tenglamada S 2- ioni emas, balki H 2 S molekulasi almashtiriladi. Kislotali muhitda oksidlangan shaklga qo'shilgan vodorod ionlari va qaytarilgan shaklga qo'shilgan suv molekulalari tenglashtirish uchun ishlatiladi. Keyin zaryadlar balansi tenglashtiriladi va chiziqning o'ng tomonida berilgan va qabul qilingan elektronlar sonini tenglashtiruvchi koeffitsientlar ko'rsatilgan. Shundan so'ng, umumiy tenglama koeffitsientlarni hisobga olgan holda quyida yoziladi:
Biz qisqartirilgan ion-molekulyar tenglamani oldik. Unga Na + va K + ionlarini qo'shish orqali biz shunga o'xshash tenglamani to'liq shaklda, shuningdek molekulyar tenglamani olamiz:
NaNO 2 + 2 KMnO 4 + 2 KOH → NaNO 3 + 2 K 2 MnO 4 + H 2 O
Neytral muhitda zarrachalar muvozanati yarim reaksiyalarning chap tomoniga suv molekulalarini qo'shish orqali tenglashtiriladi va o'ng tomoniga H + yoki OH - ionlari qo'shiladi:
I 2 + Cl 2 + H 2 O → HIO 3 + HCl
Boshlang'ich moddalar kislotalar yoki asoslar emas, shuning uchun reaktsiyaning dastlabki davrida eritmadagi muhit neytralga yaqin bo'ladi. Yarim reaksiya tenglamalari:
| I 2 + 6 H 2 O + 10e → 2 IO 3 – + 12 H + | |
| Cl 2 + 2e → 2 Cl - | |
| I 2 + 5 Cl 2 + 6 H 2 O → 2 IO 3 – + 12 H + + 10 Cl – |
Molekulyar shakldagi reaksiya tenglamasi:
I 2 + 5 Cl 2 + 6 H 2 O → 2 HIO 3 + 10 HCl.
MUHIM OKSİDLANTIRISH VA REDUSTRIENTLAR. REDOX REAKSIYALARINING TASNIFI
Elementning oksidlanish va qaytarilish chegaralari oksidlanish darajasining maksimal va minimal qiymatlari bilan ifodalanadi *. Davriy jadvaldagi o'rni bilan belgilanadigan ushbu ekstremal holatlarda element faqat bitta funktsiyani - oksidlovchi yoki reduktorni ko'rsatish imkoniyatiga ega. Shunga ko'ra, ushbu oksidlanish darajalarida elementlarni o'z ichiga olgan moddalar faqat oksidlovchi moddalar (HNO 3, H 2 SO 4, HClO 4, KMnO 4, K 2 Cr 2 O 7 va boshqalar) yoki faqat qaytaruvchi moddalar (NH 3, H 2 S, vodorod galogenidlari, Na 2 S 2 O 3 va boshqalar). Oraliq oksidlanish darajasidagi elementlarni o'z ichiga olgan moddalar ham oksidlovchi, ham qaytaruvchi moddalar (HClO, H 2 O 2, H 2 SO 3 va boshqalar) bo'lishi mumkin.
Oksidlanish-qaytarilish reaktsiyalari uchta asosiy turga bo'linadi: molekulalararo, molekula ichidagi va nomutanosiblik reaktsiyalari.
Birinchi turga oksidlovchi element va qaytaruvchi element atomlari turli molekulalarning bir qismi bo'lgan jarayonlar kiradi.
Oksidlovchi va turli elementlarning atomlari holidagi qaytaruvchi moddalar bir molekulada bo'ladigan reaksiyalar molekula ichidagi reaksiyalar deyiladi. Masalan, kaliy xloratning termal parchalanishi tenglama bo'yicha:
2 KClO 3 → 2 KCl + 3 O 2
Nomutanosiblik reaktsiyalari - bu oksidlovchi va qaytaruvchi moddaning bir xil oksidlanish darajasida bir xil element bo'lgan jarayonlari, reaksiyada ham kamayadi, ham ortadi, masalan:
3 HClO → HClO 3 + 2 HCl
Teskari nomutanosiblik reaksiyalari ham mumkin. Bularga oksidlovchi va qaytaruvchi moddalar bir xil element bo'lgan, ammo turli oksidlanish darajasida bo'lgan atomlar shaklida bo'lgan va reaksiya natijasida ularni tekislaydigan molekulyar jarayonlar kiradi.
Yangi maqolalar
- Mammoplastikadan keyingi reabilitatsiya davri - shifokor tavsiyalari va mumkin bo'lgan salbiy oqibatlar
- Homiladorlik davrida sekretsiya xususiyatlari Homiladorlik davrida oqindi uzoq vaqt snotka o'xshaydi
- Homiladorlik paytida chashka (tibbiy): uni ishlatish mumkinmi - faqat shifokor qaror qiladi!
- Homiladorlik paytida chashka (tibbiy): uni ishlatish mumkinmi - faqat shifokor qaror qiladi!
- Homilador ayollar uchun, shu jumladan erta bosqichlarda paratsetamolni qabul qilish mumkinmi yoki yo'qmi?
- Ektopik homiladorlik uchun HCG ko'rsatkichlari
- Homiladorlik paytida paratsetamolga ruxsat beriladimi?
- "Nega men armiyada xizmat qilishim kerak": o'zim bilan ochiq monolog Nega har bir erkak armiyada xizmat qilishi kerak
- Harbiy guvohnomada vus nima va uning dekodlanishi
- Rossiya tarixining sharmandali sahifalari: Afg'oniston
Mashhur maqolalar
- Novosibirsk oliy harbiy qo'mondonlik maktabi (Novosibirsk)
- Sevastopol gubernatori Sergey Kunitsin: "Biz urushdan qo'rqmasdan qaytdik" Nikolay Semenovich Patolichev
- Afsonaviy razvedkachi Aleksey Botyan Aleksandr Batyan razvedkachining tarjimai holi
- Ish topish uchun ibodat, ish qidirish
- Kiprning ibodati qisqa, Kiprning ibodati nima uchun kerak;
- Moddiy farovonlik uchun ibodat: kimga ibodat qilish kerak?
- "Buzilmas devor" belgisi oldida ibodat
- O'zingizdan zararni qanday olib tashlash mumkin
- Voltdan zararni o'zingiz qanday olib tashlashingiz mumkin
- Uy-joy, uy yoki kvartira sotib olish uchun ibodatlar


