प्रणाली के संतुलन स्थिरांक की गणना। रासायनिक संतुलन। रासायनिक संतुलन स्थिरांक
कार्य 135.
एक सजातीय प्रणाली के लिए संतुलन स्थिरांक की गणना करें
यदि अभिकारकों की सांद्रता का संतुलन (मोल / एल):
[सीओ] पी = 0.004; [एच 2 ओ] पी = 0.064; [सीओ 2] पी = 0.016; [एच 2] पी = 0.016,
पानी और सीओ की प्रारंभिक सांद्रता क्या हैं? उत्तर: के = 1; रेफरी = 0.08 मोल / एल; [सीओ] रेफरी = 0.02 मोल / एल।
समाधान:
प्रतिक्रिया समीकरण है:
सीओ (जी) + एच 2 ओ (जी) सीओ 2 (जी) + एच 2 (जी)
इस प्रतिक्रिया के लिए समीकरण स्थिरांक का व्यंजक है:
एच 2 ओ और सीओ पदार्थों की प्रारंभिक सांद्रता का पता लगाने के लिए, आइए हम ध्यान दें कि प्रतिक्रिया समीकरण के अनुसार, सीओ का 1 मोल और एच 2 ओ का 1 मोल सीओ 2 का 1 मोल और एच 2 का 1 मोल बनाता है। चूंकि, समस्या की स्थिति के अनुसार, सिस्टम के प्रत्येक लीटर में CO 2 का 0.016 mol और H 2 का 0.016 mol बनता है, तो इस मामले में 0.016 mol CO और H 2 O का उपभोग किया गया था। इस प्रकार, वांछित प्रारंभिक सांद्रता के बराबर हैं:
पूर्व = [एच 2 ओ] पी + 0.016 = 0.004 + 0.016 = 0.02 मोल / एल;
[सीओ] रेफरी = [सीओ] पी + 0.016 = 0.064 + 0.016 = 0.08 मोल / एल।
उत्तर:केपी = 1; रेफरी = 0.08 मोल / एल; [सीओ] रेफरी = 0.02 मोल / एल।
कार्य 136.
एक सजातीय प्रणाली का संतुलन स्थिरांक
एक निश्चित तापमान पर 1 है। सभी अभिकारकों की संतुलन सांद्रता की गणना करें, यदि प्रारंभिक सांद्रता समान हैं (mol / l): [CO] ref = 0.10; [एच 2 ओ] रेफरी = 0.40।
उत्तर: [सीओ 2] पी = [एच 2] पी = 0.08; [सीओ] पी = 0.02; [एच 2 ओ] पी = 0.32।
समाधान:
प्रतिक्रिया समीकरण है:
सीओ (जी) + एच 2 ओ (जी) सीओ 2 (जी) + एच 2 (जी)
संतुलन में, प्रत्यक्ष और विपरीत प्रतिक्रियाओं की दरें समान होती हैं, और इन दरों के स्थिरांक का अनुपात स्थिर होता है और इसे दिए गए सिस्टम का संतुलन स्थिरांक कहा जाता है:

हम प्रतिक्रिया उत्पादों में से एक की संतुलन एकाग्रता x mol / l से निरूपित करते हैं, फिर दूसरे की संतुलन एकाग्रता भी x mol / l होगी, क्योंकि वे दोनों एक ही मात्रा में बनते हैं। प्रारंभिक सामग्रियों की संतुलन सांद्रता होगी:
[सीओ] रेफरी = 0.10 - एक्स मोल / एल; [एच 2 ओ] रेफरी = 0.40 - एक्स मोल / एल। (चूंकि प्रतिक्रिया उत्पाद के x mol / l का निर्माण क्रमशः CO और H 2 O के x mol / l में खर्च होता है। संतुलन के क्षण में, सभी पदार्थों की सांद्रता (mol / l) होगी: [ सीओ 2] पी = [एच 2] पी = एक्स; [सीओ] पी = 0.10 - एक्स; [एच 2 ओ] पी = 0.4 - एक्स।
संतुलन स्थिरांक के व्यंजक में इन मानों को रखिए:
![]()
समीकरण को हल करने पर, हम x = 0.08 पाते हैं। इसलिए संतुलन एकाग्रता (mol / l):
[सीओ 2] पी = [एच 2] पी = एक्स = 0.08 मोल / एल;
[एच 2 ओ] पी = 0.4 - एक्स = 0.4 - 0.08 = 0.32 मोल / एल;
[सीओ] पी = 0.10 - एक्स = 0.10 - 0.08 = 0.02 मोल / एल।
टास्क 137.
एक निश्चित तापमान पर सजातीय प्रणाली N 2 + 2 = 2NH 3 का संतुलन स्थिरांक 0.1 के बराबर है। हाइड्रोजन और अमोनिया की संतुलन सांद्रता क्रमशः 0.2 और 0.08 mol / L है। संतुलन और प्रारंभिक नाइट्रोजन एकाग्रता की गणना करें। उत्तर: पी = 8 मोल / एल; रेफरी = 8.04 मोल / एल।
समाधान:
प्रतिक्रिया समीकरण है:
एन 2 + 2 = 2एनएच 3
आइए x mol / l के माध्यम से N2 की संतुलन सांद्रता को नामित करें। इस प्रतिक्रिया के संतुलन स्थिरांक के लिए व्यंजक है:

हम समीकरण में समस्या के डेटा को संतुलन स्थिरांक के लिए प्रतिस्थापित करते हैं और एकाग्रता N 2 . पाते हैं

एन 2 की प्रारंभिक एकाग्रता को खोजने के लिए, ध्यान रखें कि, एनएच 3 के 1 मोल के गठन के लिए प्रतिक्रिया समीकरण के अनुसार, एन 2 का 1/2 मोल खर्च किया जाता है। चूंकि, समस्या की स्थिति के अनुसार, सिस्टम के प्रत्येक लीटर में NH 3 का 0.08 mol बनता है, तो 0.08 . 1/2 = 0.04 मोल एन 2। इस प्रकार, एन 2 की आवश्यक प्रारंभिक एकाग्रता बराबर है:
रेफरी = पी + 0.04 = 8 + 0.04 = 8.04 मोल / एल।
उत्तर:पी = 8 मोल / एल; रेफरी = 8.04 मोल / एल।
आईबीईडब्ल्यू लोकल 138
एक निश्चित तापमान पर, एक सजातीय प्रणाली का संतुलन
2NO + O 2 ↔ 2NO 2 अभिकारकों (mol / l) की निम्नलिखित सांद्रता पर स्थापित किया गया था: p = 0.2; [ओ 2] पी = 0.1; पी = 0.1. संतुलन स्थिरांक और NO और O 2 की प्रारंभिक सांद्रता की गणना करें। उत्तर: के = 2.5; रेफरी = 0.3 मोल / एल; [ओ 2] एक्स एक्स = 0.15 मोल / एल।
समाधान:
प्रतिक्रिया समीकरण:
2NO + O 2 ↔ 2NO 2

NO और O 2 की प्रारंभिक सांद्रता को खोजने के लिए, हम ध्यान में रखते हैं कि प्रतिक्रिया समीकरण के अनुसार, NO के 2 mol और O2 के 1 mol से, NO 2 के 2 mol बनते हैं, फिर NO का 0.1 mol और का 0.05 mol बनता है। ओ 2 का सेवन किया गया। इस प्रकार, NO और 2 की प्रारंभिक सांद्रता बराबर हैं:
रेफरी = नहीं] पी + 0.1 = 0.2 + 0.1 = 0.3 मोल / एल;
[О 2] रेफरी = [О 2] पी + 0.05 = 0.1 + 0.05 = 0.15 मोल / एल।
उत्तर:केपी = 2.5; रेफरी = 0.3 मोल / एल; [ओ 2] रेफरी = 0.15 मोल / एल।
टास्क 139.
जब दाब बदलता है तो निकाय का संतुलन क्यों बदलता है?
एन 2 + 3Н 2 ↔ 2एनएच 3 और, क्या सिस्टम एन 2 + ओ 2 2NO का संतुलन है? दबाव परिवर्तन से पहले और बाद में इन प्रणालियों में आगे और पीछे की प्रतिक्रियाओं की दर की गणना के आधार पर अपने उत्तर को प्रेरित करें। इनमें से प्रत्येक प्रणाली के संतुलन स्थिरांक के लिए व्यंजक लिखिए।
समाधान:
ए) प्रतिक्रिया समीकरण:
एन 2 + 3एच 2 2एनएच 3।
यह प्रतिक्रिया समीकरण से निम्नानुसार है कि प्रतिक्रिया प्रणाली में मात्रा में कमी के साथ आगे बढ़ती है (4 मोल गैसीय पदार्थों से, 2 मोल गैसीय पदार्थ बनते हैं)। इसलिए, जब सिस्टम में दबाव बदलता है, तो संतुलन बदल जाएगा। यदि इस प्रणाली में दबाव बढ़ा दिया जाता है, तो ले चेटेलियर के सिद्धांत के अनुसार, संतुलन घटती मात्रा की दिशा में, दाईं ओर स्थानांतरित हो जाएगा। जब सिस्टम में संतुलन दाईं ओर शिफ्ट हो जाता है, तो आगे की प्रतिक्रिया की गति रिवर्स रिएक्शन की गति से अधिक होगी:
पीआर> एआर या पीआर = के 3> ओ बीआर = के 2।
यदि सिस्टम में दबाव कम हो जाता है, तो सिस्टम का संतुलन बाईं ओर शिफ्ट हो जाएगा, वॉल्यूम बढ़ाने की दिशा में, फिर जब संतुलन को बाईं ओर स्थानांतरित किया जाता है, तो प्रत्यक्ष प्रतिक्रिया की गति से कम होगी सीधी रेखा की गति:
एन एस< обр или (пр = k 3 )< (обр = k 2).
बी) प्रतिक्रिया समीकरण:
N2 + O2) 2NO। ...
प्रतिक्रिया समीकरण से यह निम्नानुसार है कि प्रतिक्रिया के दौरान मात्रा में परिवर्तन के साथ नहीं होता है, प्रतिक्रिया गैसीय पदार्थों के मोल की संख्या को बदले बिना आगे बढ़ती है। इसलिए, सिस्टम में दबाव में बदलाव से संतुलन में बदलाव नहीं होगा; इसलिए, आगे और पीछे की प्रतिक्रियाओं की दरें समान होंगी:
पीआर = एआर = या (पीआर के [ओ 2]) = (एआर = के 2)।
कार्य 140.
प्रारंभिक सांद्रता रेफरी और [C1 2] एक सजातीय प्रणाली में रेफरी
2NO + Cl 2 ↔ 2NOC1 क्रमशः 0.5 और 0.2 mol / l हैं। संतुलन स्थिरांक की गणना करें यदि संतुलन तक पहुंचने तक 20% NO ने प्रतिक्रिया की है। उत्तर: 0.417।
समाधान:
प्रतिक्रिया समीकरण है: 2NO + Сl 2 ↔ 2NOС1
समस्या की स्थिति के अनुसार, 20% NO ने प्रतिक्रिया में प्रवेश किया, जो कि 0.5 . है .
0.2 = 0.1 mol, और प्रतिक्रिया नहीं 0.5 - 0.1 = 0.4 mol NO। यह प्रतिक्रिया समीकरण से निम्नानुसार है कि NO के प्रत्येक 2 mol के लिए, Cl2 का 1 mol खपत होता है, और 2 mol NOCl बनता है। इसलिए, 0.1 mol NO के साथ, Cl 2 के 0.05 mol ने प्रतिक्रिया में प्रवेश किया और 0.1 mol NOCl का गठन किया। Cl 2 (0.2-0.05 = 0.15) के 0.15 मोल का सेवन नहीं किया। इस प्रकार, शामिल पदार्थों की संतुलन सांद्रता बराबर (mol / l) है:
पी = 0.4; पी = 0.15; पी = 0.1.
इस प्रतिक्रिया का संतुलन स्थिरांक समीकरण द्वारा व्यक्त किया जाता है:
![]()
इस व्यंजक में पदार्थों की साम्य सांद्रता को प्रतिस्थापित करने पर, हम प्राप्त करते हैं।
रासायनिक संतुलन। रासायनिक संतुलन स्थिरांक
उदाहरण 1... 298 K, 273 K और 373 K के मानक तापमान पर नाइट्रोजन डाइऑक्साइड 2NО 2 (g) = N 2 O 4 (g) की डिमराइजेशन प्रतिक्रिया में गिब्स ऊर्जा ΔG में परिवर्तन की गणना करें। प्रक्रिया की दिशा के बारे में निष्कर्ष निकालें। ऊपर बताए गए तापमान पर नाइट्रोजन डाइऑक्साइड की डिमराइजेशन प्रतिक्रिया के संतुलन स्थिरांक का निर्धारण करें। उस तापमान का निर्धारण करें जिस पर G = 0. इस तापमान के ऊपर और नीचे इस प्रतिक्रिया की दिशा के बारे में निष्कर्ष निकालें। घटकों की थर्मोडायनामिक विशेषताएं:
° 298 एस ओ 298
राशि kJ / mol J / mol * K
सं 2 (जी) 33.3 240.2
एन 2 ओ 4 (जी) 9.6 303.8
समाधान।एक प्रतिवर्ती प्रक्रिया के लिए:
एए (जी) + बीबी (जी) सीसी (जी) + डीडी (जी)
संतुलन स्थिरांक K p का व्यंजक होगा
के पी = (पी सी सी * पी डी डी) / (पी ए ए * पी बी बी)
जहां P A, P B, P C, P D गैसीय घटकों के संतुलन आंशिक दबाव हैं A, B, C, D a, b, c, d स्टोइकोमेट्रिक गुणांक हैं।
प्रक्रिया के लिए एए (जी) + बीबी (एफ) सी सी(जी) + डीडी (जी) संतुलन स्थिरांक के लिए अभिव्यक्ति
के सी = (सी सी सी * सी डी डी) / (सी ए ए * सी बी बी)
जहां सी ए, सी बी, सी सी, सी डी - पदार्थों ए, बी, सी, डी ए, बी, सी, डी - स्टोइकोमेट्रिक गुणांक की संतुलन सांद्रता।
सिस्टम के लिए सूत्र (1.4.1) द्वारा 2NO 2 N 2 O 4 हमारे पास है
के पी = पी एन 2 ओ 4 / पी 2 नहीं 2
298 K के मानक तापमान पर, थैलेपी (ΔH o प्रतिक्रिया) में परिवर्तन सूत्र द्वारा निर्धारित किया जाता है (1.2.2)
H o प्रतिक्रिया = ° 298 N 2 O 4 - 2ΔΗ ° 298 NO 2 = 9.6-2 * 33.5 = -57400 J।
एन्ट्रापी परिवर्तन (1.3.5)
S o प्रतिक्रिया = S ° 298 N2O4 - 2S ° 298 NO2 = 303.8-2 * (240, 2) = - 176 J / mol * K
ले चेटेलियर के सिद्धांत का उपयोग करते हुए, जो कहता है कि जब स्थितियां बदलती हैं जिसके तहत एक प्रतिवर्ती प्रतिक्रिया संतुलन की स्थिति में होती है, तो संतुलन कमजोर होने की प्रक्रिया के पक्ष में स्थानांतरित हो जाएगा, हम संतुलन बदलाव की दिशा की भविष्यवाणी करेंगे। o का मान ऋणात्मक है, इसलिए गठन प्रतिक्रिया एक्ज़ोथिर्मिक है (यह गर्मी की रिहाई के साथ जाती है) और तापमान में कमी के साथ, तापमान में वृद्धि के साथ संतुलन को दाईं ओर स्थानांतरित करना चाहिए - बाईं ओर। इसके अलावा, फॉर्म (1.3.6) द्वारा, यह जानते हुए कि H
जी ओ 273; जी ओ 298; जी ओ 373 और के 273; कश्मीर 298; कश्मीर 373
दिए गए तापमान के लिए गिब्स ऊर्जा के मूल्य की गणना सूत्र (1.3.7) द्वारा की जाती है:
G o 298 = H o -TΔS o = -57400-298 * (- 176) = - 4952जे।,
जी ओ 273 = -57400-273 * (- 176) = - 9352 जे:
जी ओ 373 = -57400-373 * (- 176) = 7129 जे।
ΔG o 298 का एक ऋणात्मक मान प्रतिक्रिया के संतुलन में दाईं ओर एक बदलाव को इंगित करता है, और G o 273 का एक उच्च ऋणात्मक मान इंगित करता है कि तापमान में (298 से 273 K) की कमी के साथ, संतुलन दाईं ओर शिफ्ट हो जाता है .
G o 373 का धनात्मक मान स्वतःस्फूर्त प्रक्रिया की दिशा में परिवर्तन को दर्शाता है। इस तापमान पर, विपरीत प्रतिक्रिया बेहतर हो जाती है (बाएं संतुलन का विस्थापन)।
संतुलन स्थिरांक p और गिब्स ऊर्जा G o सूत्र द्वारा संबंधित हैं
जहाँ K p प्रक्रिया का संतुलन स्थिरांक है; आर गैस स्थिरांक है; टी परम तापमान है। सूत्र (1.4.3) से हमारे पास है:
एलएनके 273 = - जी ओ 273 / आरटी = 9352 / 8.31 * 273 = 4.12
एलएनके 298 = -Δजी ओ 298 / आरटी = 4952 / 8.31 * 298 = 2
एलएनके 373 = -Δजी ओ 373 / आरटी = -7129 / 8.31 * 298 = -2.3
K 298 और K 273> 1 का मान संतुलन के दाईं ओर शिफ्ट होने का संकेत देता है (तुलना करें (1.4.1) से) और जितना अधिक होगा, संतुलन स्थिरांक का मान उतना ही अधिक होगा। कश्मीर 373< 1, говорит ο смещении равновесия в системе влево (сравни с (1.4.1)).
स्थिति G o प्रतिक्रिया = 0 संतुलन स्थिरांक से मेल खाती है,
एक के बराबर।
आइए हम सूत्र (1.3.7) का उपयोग करके इस स्थिरांक के अनुरूप तापमान T की गणना करें:
ΔG ° = ΔΗ ° -TΔS ओ; ओ = Δएच ओ -टीΔएस ओ;
टी Δ जी = 0 = ° / ΔS ° = 57400/176 = 326.19 K
आउटपुट 326.19 K के तापमान पर, प्रत्यक्ष और विपरीत प्रतिक्रियाएँ समान संभावना के साथ आगे बढ़ती हैं, K p = 1। तापमान में कमी के साथ, संतुलन बाईं ओर बढ़ने के साथ दाईं ओर शिफ्ट हो जाएगा।
उदाहरण 2... प्रतिक्रिया N . के अनुसार NH 3 के संश्लेषण की प्रतिक्रिया का संतुलन स्थिरांक 2+3 H2 == 2NH 3 623 K पर 2.32 * 10 -13 के बराबर होता है। उसी तापमान पर Kc की गणना करें।
समाधान।कनेक्शन K p और K s सूत्र के अनुसार किया जाता है
के पी = के सी (आरटी) एन, (1.4.4)
n = n 2 - n 1 = 2-4 = -2, जहां n 1 और n 2 पीजेंट और उत्पादों के मोलों की संख्या है। अत,
के सी = के पी / (आरटी) एन = 0.624 * 10 -5
उत्तर... के = 0.624 * 10 -5।
उदाहरण 2। 1154 K पर कैल्शियम कार्बोनेट की वियोजन लोच 80380 Pa और 1164 K - 91177 Pa पर है। गणना करें कि किस तापमान पर कैल्शियम कार्बोनेट की वियोजन लोच 101325 Pa के बराबर होगी।
समाधान।पृथक्करण प्रतिक्रिया CaCO 3 (सीआर) सीएओ (सीआर) + СО 2 (जी)
अत: (1.4.1) से
के पी = पी सीओ 2
इसलिए, प्रत्येक तापमान पर (टी 1 - 1154 के; = 1164 के * = एक्स) संतुलन स्थिरांक दबाव के अनुरूप होंगे:
के टी 1 = 80380; के टी 2 = 91177; के टी 3 = 101325।
तापमान पर संतुलन स्थिरांक की निर्भरता को अरहेनियस समीकरण द्वारा दिखाया गया है
डीएलएनके पी / डीटी = / आरटी 2 (1.4.5)
जहां K p संतुलन स्थिरांक है; - तापमान, के; ΔΗ प्रतिक्रिया का ऊष्मीय प्रभाव है; R गैस स्थिरांक है।
तापमान रेंज T 1 -T 2 में H = const पर समीकरण (1.4.5) को एकीकृत करना हम प्राप्त करते हैं
एलएनके टी 1 / के टी 2 = ΔΗ / आर (1 / टी 1 -1 / टी 2),
जहां के टी 1 और के टी 2 टी 1 और टी 2 पर संतुलन स्थिरांक हैं।
आइए पहले को परिभाषित करें (1.4.6 से)
= एलएन (91177 * 8.31 * 1154 * 1164/80380 * 10) = 140500 जे / मोल।
एलएन (101325/91177) = 140500 / 8.31 (1 / 1164-1 / टी 3)
टी 3 = 1172 के
उत्तर। T = 1172K पर, कैल्शियम कार्बोनेट की वियोजन लोच 101325 Pa के बराबर होगी।
कार्य
56. 298 K पर एसिटिक अम्ल का वियोजन स्थिरांक 1.75 * 10 -5 है। ऐसीटिक अम्ल की गिब्स वियोजन ऊर्जा में क्या परिवर्तन होता है?
57. प्रतिक्रिया BaSО 4 (cr) → Ba 2+ (p) + SO 2- 4 (p) के लिए गिब्स ऊर्जा (ΔG o 298) और संतुलन स्थिरांक K 298 का मान ज्ञात कीजिए।
गणना के लिए निम्नलिखित डेटा का उपयोग करें:
पदार्थ एस ओ 298 जे / मोल * के एच ओ 298 केजे / मोल 2 ^ 2 ^
बेसो 4 (करोड़) 132.4 -1447.39
बा 2+ (पी) 9.64 -533.83
एसओ 2- 4 (पी) 18.44 -904.2।
58. एथिलीन जलयोजन की प्रतिक्रिया के लिए 473 K पर संतुलन स्थिरांक ज्ञात कीजिए
सी 2 एच 4 (जी) + एच 2 ओ (जी) = सी 2 एच 5 ओएच (जी)।
तालिका में अभिकर्मकों के गुण लें। 3. तापमान पर ΔS और H की निर्भरता की उपेक्षा करें।
59. इसे ध्यान में रखते हुए एच ओ 298तथा एस के बारे में 298अभिक्रियाएँ 4HCl + O 2 ⇄ 2Н 2 О + 2Сl 2 तापमान पर निर्भर नहीं करती, वह तापमान ज्ञात कीजिए जिस पर
के पी = 1, और Δजी ओ = ओ
60. सारणीबद्ध आँकड़ों का उपयोग करते हुए, 298 K और 1000 K पर निम्नलिखित प्रतिक्रियाओं के संतुलन स्थिरांक की गणना करें:
ए) एच 2 ओ (जी) + सीओ सीओ 2 + एच 2
बी) सीओ 2 + सी (जीआर) ⇄ 2CO;
ग) एन 2 + 3एच 2 2एनएच 3।
तापमान पर ΔH o और S o में परिवर्तन की उपेक्षा करें।
61. कुछ स्वतःस्फूर्त प्रतिक्रिया के लिए S< О. Как будет изменяться константа равновесия с повышением температуры: а) увеличиваться, б) уменьшаться, в) по данным задачи нельзя определить.
62. गणनाओं का उपयोग किए बिना, निम्नलिखित प्रक्रियाओं का चिह्न S o सेट करें:
ए) 2एनएच 3 (डी) एन 2 (डी) + एच 2 (डी);
बी) सीओ 2 (सीआर) सीओ 2 (डी);
सी) 2NO (जी) + ओ 2 (जी) = 2NO 2 (जी);
d) 2H 2 S (g) + 3O 2 = 2H 2 O (g) + 2SO 2 (g);
ई) 2CH 3 OH (g) + 3O 2 (g) = 4H 2 O (g) + 2CO 2 (g)।
63. निम्नलिखित में से किस स्थिति में, किसी भी तापमान पर प्रतिक्रिया संभव है: a) °< 0, ΔS°>0; बी) एन °<0, ΔS°<0; в) Δ Н°>0, S °> 0?
64. निम्नलिखित में से किस मामले में, किसी भी तापमान पर प्रतिक्रिया संभव नहीं है: ए) ΔH °> 0, ΔS °> 0; बी) °> 0, S °<0; в) Δ Н°<0, ΔS°<0 ?
65. यदि °<0 и ΔS°<0 ,
किस स्थिति में प्रतिक्रिया स्वतःस्फूर्त रूप से आगे बढ़ सकती है:
क) | ° | > | टीΔएस ° |; बी) | ° | > | टीΔएस ° | ?
66. सिस्टम पर कौन से प्रभाव सिस्टम के संतुलन को बदल सकते हैं:
ए) एन 2 (डी) + 3 एच 2 (डी) ⇄ 2एनएच 3 (डी);
बी) 4Fe (सीआर) + 3O 2 (डी) ⇄ 2Fe 2 ओ 3 (सीआर);
सी) एसओ 2 (जी) + ओ 2 (जी) 2SO 3 (जी)।
67. सिस्टम में बढ़ते तापमान के साथ संतुलन किस दिशा में बदल जाएगा:
1) COCl 2 CO + Cl 2; ΔH ° = 113 kJ;
2) 2CO CO 2 + C; ΔH ° = -171 kJ;
3) 2SO 3 ⇄ 2SO 2 + O 2; ° = 192 kJ।
68. सिस्टम में बढ़ते दबाव के साथ संतुलन किस दिशा में स्थानांतरित होगा:
1) एच 2 (जी) + एस (सीआर) ⇄ एच 2 एस (जी);
2) 2CO (g) CO 2 (g) + C (g);
3) 4HCl (g) + O 2 (g) ⇄ 2H 2 O (g) + 2Cl 2 (g)।
69. निम्नलिखित प्रतिक्रियाएं संतुलन को कैसे प्रभावित करेंगी:
सीएसीओ 3 (सीआर) ⇄ सीएओ (सीआर) + सीओ 2 (जी); H ° = 178 kJ;
2CO (g) + O 2 (g) 2CO 2; ΔH ° = -566 केजे;
एन 2 (जी) + ओ 2 (जी) 2NO (जी); ° = 180 kJ.
ए) तापमान में वृद्धि,
बी) दबाव में वृद्धि?
70. संदर्भ डेटा का उपयोग करते हुए, उस तापमान का अनुमानित मान ज्ञात कीजिए जिस पर जल गैस बनने की प्रतिक्रिया का संतुलन स्थिरांक
सी (जीआर) + एच 2 ओ (जी) सीओ (जी) + एच 2 (जी)
1 के बराबर है। H o और S o की तापमान निर्भरता की उपेक्षा की जानी चाहिए।
71. प्रतिक्रिया का संतुलन स्थिरांक K p CO + Cl 2 ⇄ COCl 2 600 o C पर 1.67 * 10 -6 के बराबर है। दिए गए तापमान पर प्रतिक्रिया के K c की गणना करें।
72. 1000 K पर मैग्नीशियम कार्बोनेट की पृथक्करण लोच 42189 Pa है, और 1020 K - 80313 Pa पर है। प्रतिक्रिया का गर्मी प्रभाव निर्धारित करें एमजीसीओ 3 ⇄ एमजीओ + सीओ 2 और वह तापमान जिस पर मैग्नीशियम कार्बोनेट की पृथक्करण लोच 1 पा हो जाती है।
रासायनिक संतुलन प्रतिवर्ती रासायनिक प्रतिक्रिया की स्थिति है।
एए + बीबी = सीसी + डीडी,
जिसमें, समय के साथ, प्रतिक्रिया मिश्रण में अभिकारकों की सांद्रता में कोई परिवर्तन नहीं होता है। रासायनिक संतुलन की स्थिति की विशेषता है रासायनिक संतुलन स्थिरांक:
कहां सी मैं- घटकों की एकाग्रता संतुलनएकदम सही मिश्रण।
संतुलन स्थिरांक को संतुलन मोल भिन्न के रूप में भी व्यक्त किया जा सकता है एक्स मैंअवयव:
गैस चरण में होने वाली प्रतिक्रियाओं के लिए, संतुलन आंशिक दबावों के संदर्भ में संतुलन स्थिरांक को व्यक्त करना सुविधाजनक है पी आईअवयव:
आदर्श गैसों के लिए पी आई = सी मैं आरटीईतथा पी आई = एक्स आई पी, कहां पीकुल दबाव है, इसलिए के पी, कश्मीरतथा के एक्सनिम्नलिखित संबंधों से संबंधित हैं:
के पी = के सी (आरटी) सी + डी - ए - बी = के एक्स पी सी + डी - ए - बी. (9.4)
संतुलन स्थिरांक से संबंधित है आर जीओ रासायनिक प्रतिक्रिया:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
परिवर्तन आर जीया आर एफदिए गए (जरूरी नहीं कि संतुलन) आंशिक दबाव पर एक रासायनिक प्रतिक्रिया में पी आईया सांद्रता सी मैंघटकों की गणना समीकरण द्वारा की जा सकती है रासायनिक प्रतिक्रिया इज़ोटेर्मस (वैंट हॉफ इज़ोटेर्मस):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
के अनुसार ले चेटेलियर सिद्धांत, यदि संतुलन में एक प्रणाली पर एक बाहरी प्रभाव डाला जाता है, तो संतुलन बदल जाएगा ताकि बाहरी प्रभाव के प्रभाव को कम किया जा सके। इस प्रकार, दबाव में वृद्धि संतुलन को गैस के अणुओं की संख्या में कमी की ओर ले जाती है। संतुलन मिश्रण में किसी भी प्रतिक्रिया घटक को जोड़ने से इस घटक की मात्रा में कमी की ओर संतुलन बदल जाता है। तापमान में वृद्धि (या कमी) गर्मी के अवशोषण (मुक्ति) के साथ आगे बढ़ने वाली प्रतिक्रिया की ओर संतुलन को बदल देती है।
तापमान पर संतुलन स्थिरांक की निर्भरता को समीकरण द्वारा मात्रात्मक रूप से वर्णित किया जाता है रासायनिक प्रतिक्रिया आइसोबार (वैंट हॉफ आइसोबार्स)
![]() (9.9)
(9.9)
तथा रासायनिक प्रतिक्रिया आइसोकोर्स (वैंट हॉफ आइसोकोर्स)
![]() . (9.10)
. (9.10)
समीकरण का एकीकरण (9.9) इस धारणा के तहत कि आर एचप्रतिक्रिया तापमान पर निर्भर नहीं करती है (जो कि संकीर्ण तापमान रेंज में सच है), देता है:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
कहां सी -एकीकरण की निरंतरता। इस प्रकार, निर्भरता ln क 1 . से पी /टीरैखिक होना चाहिए, और सीधी रेखा का ढलान है - आर एच/आर.
भीतर एकीकरण क 1 , क 2, और टी 1, टी 2 देता है:
 (9.13)
(9.13)
 (9.14)
(9.14)
इस समीकरण का उपयोग करते हुए, दो अलग-अलग तापमानों पर संतुलन स्थिरांक को जानकर, हम गणना कर सकते हैं आर एचप्रतिक्रियाएं। तदनुसार, जानना आर एचएक तापमान पर प्रतिक्रिया और संतुलन स्थिरांक, आप दूसरे तापमान पर संतुलन स्थिरांक की गणना कर सकते हैं।
उदाहरण
सीओ (जी) + 2 एच 2 (जी) = सीएच 3 ओएच (जी)
500 के. एफ जी ओ 500 K पर CO (g) और CH 3 OH (g) के लिए -155.41 kJ हैं। मोल -1 और -134.20 kJ। मोल -1, क्रमशः।
समाधान। जानाप्रतिक्रियाएं:
आर जी ओ= एफ जी ओ(सीएच 3 ओएच) - एफ जी ओ(सीओ) = -134.20 - (-155.41) = 21.21 केजे। मोल -1।
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
उदाहरण 9-2। प्रतिक्रिया का संतुलन स्थिरांक
के बराबर है क P = 1.64 10 -4 400 o C पर। N 2 के 10% को NH 3 में बदलने के लिए N 2 और H 2 के एक विषुवतीय मिश्रण पर कुल कितना दबाव लागू किया जाना चाहिए? गैसों को आदर्श माना जाता है।
समाधान। बता दें कि N 2 के मोल ने प्रतिक्रिया दी है। फिर
| एन 2 (डी) | + | 3एच 2 (डी) | = | 2एनएच 3 (जी) | |
| प्रारंभिक मात्रा | 1 | 1 | |||
| संतुलन मात्रा | 1– | 1–3 | 2 (कुल: 2-2) | ||
| संतुलन मोल अंश: |
अत, कएक्स = 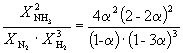 तथा के पी = के एक्स। पी –2
=
तथा के पी = के एक्स। पी –2
=  .
.
परिणामी सूत्र में = 0.1 को प्रतिस्थापित करने पर, हमारे पास है
1.64 10 –4 = , कहां पी= 51.2 एटीएम।
, कहां पी= 51.2 एटीएम।
उदाहरण 9-3. प्रतिक्रिया का संतुलन स्थिरांक
सीओ (जी) + 2 एच 2 (जी) = सीएच 3 ओएच (जी)
500 K पर के बराबर है कपी = 6.09 10 -3। प्रतिक्रिया मिश्रण, जिसमें CO का 1 mol, H 2 का 2 mol और एक अक्रिय गैस (N 2) का 1 mol शामिल है, को 500 K और कुल दबाव 100 atm तक गर्म किया गया। संतुलन मिश्रण की संरचना की गणना करें।
समाधान। CO के एक मोल को अभिक्रिया करने दें। फिर
| सीओ (जी) | + | 2एच 2 (डी) | = | सीएच 3 ओएच (जी) | |
| मूल राशि: | 1 | 2 | 0 | ||
| संतुलन राशि: | 1– | 2–2 | |||
| संतुलन मिश्रण में कुल: | 3-2 मोल घटक + 1 मोल एन 2 = 4-2 मोल | ||||
| संतुलन मोल अंश | |||||
अत, कएक्स =  तथा के पी = के एक्स। पी -2 =
तथा के पी = के एक्स। पी -2 = ![]() .
.
अत: 6.09 10 -3 = ![]() .
.
इस समीकरण को हल करने पर हमें = 0.732 प्राप्त होता है। तदनुसार, संतुलन मिश्रण में पदार्थों के दाढ़ अंश हैं: = 0.288, = 0.106, = 0.212 और = 0.394।
उदाहरण 9-4। प्रतिक्रिया के लिए
एन 2 (जी) + 3 एच 2 (जी) = 2एनएच 3 (जी)
298 K . पर कपी = 6.0 10 5, ए एफ एच ओ(एनएच 3) = -46.1 केजे। मोल -1। 500 K पर संतुलन स्थिरांक के मान का अनुमान लगाएं।
समाधान। प्रतिक्रिया की मानक दाढ़ थैलीपी है
आर एच ओ= 2एफ एच ओ(एनएच 3) = -92.2 केजे। मोल -1।
समीकरण (9.14) के अनुसार,  =
=
एलएन (6.0 10 5) + ![]() = -1.73, जहां से क 2 =
0.18.
= -1.73, जहां से क 2 =
0.18.
ध्यान दें कि बढ़ते तापमान के साथ एक्ज़ोथिर्मिक प्रतिक्रिया का संतुलन स्थिरांक कम हो जाता है, जो ले चेटेलियर सिद्धांत से मेल खाता है।
कार्य
- 1273 K पर और संतुलन मिश्रण में 30 atm का कुल दबाव
- 2000 o C और 1 ATM के कुल दबाव पर, 2% पानी हाइड्रोजन और ऑक्सीजन में अलग हो जाता है। प्रतिक्रिया के संतुलन स्थिरांक की गणना करें
- प्रतिक्रिया का संतुलन स्थिरांक
- प्रतिक्रिया का संतुलन स्थिरांक
- 1.79 10-2 mol I 2 वाले 3 L के बर्तन को 973 K तक गर्म किया गया। संतुलन पर बर्तन में दबाव 0.49 atm पाया गया। यह मानते हुए कि गैसें आदर्श हैं, प्रतिक्रिया के लिए 973 K पर संतुलन स्थिरांक की गणना करें
- प्रतिक्रिया के लिए
- प्रतिक्रिया के लिए
- पीसीएल 5 के 0.341 मोल और एन 2 के 0.233 मोल वाले 1 एल के बर्तन को 250 डिग्री सेल्सियस तक गर्म किया गया। संतुलन पर पोत में कुल दबाव 29.33 एटीएम पाया गया। सभी गैसों को आदर्श मानकर, पात्र में होने वाली अभिक्रिया के लिए 250 o C पर संतुलन स्थिरांक की गणना कीजिए
- प्रतिक्रिया का संतुलन स्थिरांक
- 25 o C . पर एफ जी ओ(एनएच 3) = -16.5 केजे। मोल -1। गणना आर जीएन 2, एच 2 और एनएच 3 के आंशिक दबावों पर क्रमशः 3 एटीएम, 1 एटीएम और 4 एटीएम के बराबर एनएच 3 के गठन की प्रतिक्रियाएं। इन परिस्थितियों में अभिक्रिया स्वतः किस दिशा में जाएगी?
- उष्माक्षेपी प्रतिक्रिया
- बोर्नियोल (सी 10 एच 17 ओएच) से आइसोबोर्नोल के आइसोमेराइजेशन की गैस-चरण प्रतिक्रिया का संतुलन स्थिरांक 503 के पर 0.106 है। 7.5 ग्राम बोर्नियोल और 14.0 ग्राम आइसोबोर्नोल का मिश्रण 5 एल पोत में रखा गया था और रखा गया था संतुलन तक पहुंचने तक 503 K। संतुलन मिश्रण में बोर्नियोल और आइसोबोर्नियोल के मोल अंशों और द्रव्यमानों की गणना करें।
- प्रतिक्रिया में संतुलन
- 400 o C पर आयतन द्वारा 10% NH 3 युक्त संतुलन मिश्रण प्राप्त करने के लिए 3 भागों H 2 और 1 भाग N 2 के मिश्रण पर लागू होने वाले कुल दबाव की गणना करें। प्रतिक्रिया के लिए संतुलन स्थिरांक
- 250 o C पर और 1 atm के कुल दबाव पर, PCl 5 प्रतिक्रिया द्वारा 80% से अलग हो जाता है
- प्रतिक्रिया के लिए 2000 o C पर
- प्रतिक्रिया की मानक थैलीपी की गणना करें जिसके लिए संतुलन स्थिरांक है
a) 2 गुना बढ़ जाता है, b) 2 गुना घट जाता है जब तापमान 298 K से 308 K तक बदल जाता है। - प्रतिक्रिया 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) के संतुलन स्थिरांक की निर्भरता 300 K और 600 K के बीच के तापमान पर समीकरण द्वारा वर्णित है
सीओ 2 (जी) + सी (टीवी) = 2CO (जी)
इसमें 17% (मात्रा के अनुसार) CO2 होता है। 20 atm के कुल दाब पर गैस में CO2 का कितना प्रतिशत होगा? किस दाब पर गैस में 25% CO2 होगी?
एच 2 ओ (जी) = एच 2 (जी) + 1/2 ओ 2 (जी) इन शर्तों के तहत।
सीओ (जी) + एच 2 ओ (जी) = सीओ 2 (जी) + एच 2 (जी)
500 o C पर . के बराबर है कश्मीर पी= 5.5. इस तापमान पर 1 mol CO और 5 mol H2O के मिश्रण को गर्म किया गया। संतुलन मिश्रण में एच 2 ओ के दाढ़ अंश की गणना करें।
एन 2 ओ 4 (जी) = 2NO 2 (जी)
25 o C के बराबर है कश्मीर पी= 0.143। उस दबाव की गणना करें जो 1 लीटर के बर्तन में स्थापित किया जाएगा जिसमें इस तापमान पर 1 ग्राम एन 2 ओ 4 रखा गया था।
मैं 2 (जी) = 2आई (जी)।
250 ओ सी . पर आर जीओ = -2508 जे मोल -1। पीसीएल 5 के पीसीएल 3 और सीएल 2 के 250 डिग्री सेल्सियस पर रूपांतरण की डिग्री किस कुल दबाव पर 30% होगी?
2HI (जी) = एच 2 (जी) + आई 2 (जी)
निरंतर संतुलन क P = 1.83 10 –2 698.6 K पर। तीन लीटर के बर्तन में 10 ग्राम I 2 और 0.2 ग्राम एच 2 को इस तापमान पर गर्म करने पर कितने ग्राम HI बनते हैं? H 2, I 2 और HI के आंशिक दबाव क्या हैं?
पीसीएल 5 (जी) = पीसीएल 3 (जी) + सीएल 2 (जी)
सीओ (जी) + 2 एच 2 (जी) = सीएच 3 ओएच (जी)
500 K पर के बराबर है कपी = 6.09 10 -3। जब CO और H2 को 1:2 के अनुपात में लिया जाता है, तो 90% उपज में मेथनॉल का उत्पादन करने के लिए आवश्यक कुल दबाव की गणना करें।
सीओ (जी) + 2 एच 2 (जी) = सीएच 3 ओएच (जी)
500 K और 10 bar पर संतुलन में है। यदि गैसें आदर्श हैं, तो निम्नलिखित कारक मेथनॉल की उपज को कैसे प्रभावित करेंगे: a) में वृद्धि टी; बी) वृद्धि पी; ग) पर एक अक्रिय गैस जोड़ना वी= स्थिरांक; d) पर एक अक्रिय गैस जोड़ना पी= स्थिरांक; ई) एच 2 को जोड़ना पी= स्थिरांक?
2NOCl (जी) = 2NO (जी) + सीएल 2 (जी)
एनओसीएल आंशिक दबाव 0.64 बार (शुरुआत में केवल एनओसीएल मौजूद था) होने पर 227 डिग्री सेल्सियस और 1.0 बार का कुल दबाव सेट किया गया है। गणना आर जी ओप्रतिक्रिया के लिए। Cl 2 आंशिक दाब किस कुल दाब पर 0.10 bar होगा?
एन 2 (जी) + 3 एच 2 (जी) = 2एनएच 3 (जी)
400 डिग्री सेल्सियस पर बराबर है क = 1.60 10 –4 .
पीसीएल 5 (जी) = पीसीएल 3 (जी) + सीएल 2 (जी)।
पीसीएल 5 के पृथक्करण की डिग्री क्या होगी यदि एन 2 को सिस्टम में जोड़ा जाता है ताकि नाइट्रोजन का आंशिक दबाव 0.9 एटीएम हो? कुल दबाव 1 बजे बनाए रखा जाता है।
एन 2 (जी) + ओ 2 (जी) = 2NO (जी)
के पी = 2.5 10 -3। 1 बार के कुल दबाव पर N 2, O 2, NO और एक अक्रिय गैस के संतुलन मिश्रण में 80% (v / v) N 2 और 16% O 2 होता है। आयतन के अनुसार कितने प्रतिशत NO है? अक्रिय गैस का आंशिक दाब कितना होता है?
एलएन क = –1.04 –1088 /टी +1.51 10 5 /टी 2 .
अध्ययन प्रश्न
संतुलन की स्थिति
निरंतर संतुलन
संतुलन सांद्रता की गणना
रासायनिक संतुलन बदलाव। ले चेटेलियर का सिद्धांत
संतुलन की स्थिति
समान परिस्थितियों में एक साथ विपरीत दिशाओं में आगे बढ़ने वाली अभिक्रियाओं को उत्क्रमणीय कहते हैं.
एक बंद प्रणाली में होने वाली प्रतिवर्ती प्रतिक्रिया पर विचार करें
आगे की प्रतिक्रिया दर समीकरण द्वारा वर्णित है:
 जनसंपर्क = कजनसंपर्क [ए] [बी],
जनसंपर्क = कजनसंपर्क [ए] [बी],
कहां  पीआर प्रत्यक्ष प्रतिक्रिया की गति है;
पीआर प्रत्यक्ष प्रतिक्रिया की गति है;
कपीआर प्रत्यक्ष प्रतिक्रिया की दर स्थिरांक है।
समय के साथ अभिकर्मकों की सांद्रता एतथा वीघटती है, प्रतिक्रिया दर घटती है (चित्र 1, वक्र  एनएस)।
एनएस)।
के बीच प्रतिक्रिया एतथा वीपदार्थों के निर्माण की ओर ले जाता है सीतथा डी, जिसके अणु टकराने पर फिर से पदार्थ दे सकते हैं एतथा वी.
पीछे की प्रतिक्रिया दर समीकरण द्वारा वर्णित है:
 गिरफ्तारी = क
गिरफ्तारी [सी] [डी],
गिरफ्तारी = क
गिरफ्तारी [सी] [डी],
कहां  ओब्र - रिवर्स रिएक्शन की गति;
ओब्र - रिवर्स रिएक्शन की गति;
क obr - रिवर्स रिएक्शन की दर स्थिर।
पदार्थों की सांद्रता के रूप में सीतथा डीवृद्धि, विपरीत प्रतिक्रिया की दर बढ़ जाती है (चित्र 1, वक्र  गिरफ्तार)।
गिरफ्तार)।

चित्र एक। समय में आगे और पीछे की प्रतिक्रियाओं की दरों में परिवर्तन
अधिक समय तक आगे और पीछे की प्रतिक्रियाओं की दर समान हो जाती है:
 जनसंपर्क =
जनसंपर्क =  आगमन
आगमन
प्रणाली की इस स्थिति को कहा जाता है संतुलन की स्थिति .
संतुलन की स्थिति में, इसके सभी प्रतिभागियों की सांद्रता समय के साथ बदलना बंद कर देती है। . ऐसी सांद्रता कहलाती हैं संतुलन .
रासायनिक संतुलन – यह है गतिशील संतुलन।एक बंद प्रणाली में मौजूद पदार्थों की सांद्रता की अपरिवर्तनीयता लगातार चल रही रासायनिक प्रक्रियाओं का परिणाम है। आगे और पीछे की प्रतिक्रियाओं की दर शून्य के बराबर नहीं है, और प्रक्रिया की प्रेक्षित दर शून्य के बराबर है।
आगे और पीछे की प्रतिक्रियाओं की दरों की समानता रासायनिक संतुलन की गतिज स्थिति है।
2. संतुलन स्थिरांक
जब आगे और पीछे की प्रतिक्रियाओं की गति समान होती है
 जनसंपर्क =
जनसंपर्क =  आगमन
आगमन
निष्पक्ष समानता
कजनसंपर्क [ए] [बी] = कगिरफ्तारी [सी] [डी],
कहां [ ए], [बी], [साथ], [डी] - पदार्थों की संतुलन सांद्रता।
चूंकि दर स्थिरांक एकाग्रता पर निर्भर नहीं करते हैं, इसलिए समानता को अलग तरह से लिखा जा सकता है:

आगे और पीछे की प्रतिक्रियाओं के दर स्थिरांक का अनुपात ( क एन एस / क आगमन ) रासायनिक संतुलन का स्थिरांक कहा जाता है:
|
|
वास्तविक रासायनिक संतुलन तभी स्थापित किया जा सकता है जब प्रतिक्रिया तंत्र के सभी प्रारंभिक चरण संतुलन में हों। कोई फर्क नहीं पड़ता कि प्रत्यक्ष और रिवर्स प्रतिक्रियाओं के तंत्र कितने जटिल हैं, संतुलन की स्थिति में उन्हें प्रतिक्रिया उत्पादों में प्रारंभिक पदार्थों का एक स्टोइकोमेट्रिक संक्रमण प्रदान करना चाहिए और इसके विपरीत। इसका मतलब है कि प्रक्रिया के सभी चरणों का बीजगणितीय योग प्रतिक्रिया के स्टोइकोमेट्रिक समीकरण के बराबर है, अर्थात। स्टोइकोमेट्रिक गुणांक तंत्र के सभी चरणों की आणविकताओं का योग है।
एक जटिल प्रतिक्रिया के लिए
एए + बीबी सीसी + डीडी
|
के सी = |
समान तापमान के लिए, स्टोइकोमेट्रिक गुणांक के बराबर शक्तियों में प्रतिक्रिया उत्पादों के संतुलन सांद्रता के उत्पाद का अनुपात स्टोइकोमेट्रिक गुणांक के बराबर शक्तियों में प्रारंभिक पदार्थों के संतुलन सांद्रता के उत्पाद का अनुपात एक स्थिर मूल्य है.
यह काम पर जनता के कानून का दूसरा सूत्रीकरण है।
विषमांगी प्रतिक्रिया के संतुलन स्थिरांक की अभिव्यक्ति में केवल तरल या गैसीय चरण में पदार्थों की सांद्रता शामिल होती है, क्योंकि ठोस पदार्थों की सांद्रता, एक नियम के रूप में, स्थिर रहती है।
उदाहरण के लिए, निम्नलिखित प्रतिक्रिया के संतुलन स्थिरांक के लिए व्यंजक:
2 (जी) + (टीवी) 2СО (जी)
इस तरह लिखा:
प्रतिसी =  .
.
संतुलन स्थिरांक समीकरण से पता चलता है कि संतुलन की स्थिति में प्रतिक्रिया में भाग लेने वाले सभी पदार्थों की सांद्रता संबंधित होती है। संतुलन स्थिरांक का संख्यात्मक मान यह निर्धारित करता है कि सभी प्रतिक्रियाशील पदार्थों की सांद्रता का अनुपात संतुलन पर क्या होना चाहिए।
इनमें से किसी भी पदार्थ की सांद्रता में परिवर्तन से अन्य सभी पदार्थों की सांद्रता में परिवर्तन होता है। नतीजतन, नई सांद्रता स्थापित की जाती है, लेकिन उनके बीच का अनुपात फिर से संतुलन स्थिरांक से मेल खाता है।
संतुलन स्थिरांक का मान निर्भर करता है अभिकारकों की प्रकृति और तापमान।
अभिकारकों की दाढ़ सांद्रता के रूप में व्यक्त संतुलन स्थिरांक ( प्रतिसाथ) और संतुलन स्थिरांक, संतुलन आंशिक दबावों के रूप में व्यक्त किया जाता है ( प्रतिआर) (देखें "रासायनिक थर्मोडायनामिक्स के बुनियादी सिद्धांत") संबंधों से जुड़े हुए हैं:
प्रतिआर= केसाथआर टी , कसी = केआर / (आर टी) ,
जहाँ अभिक्रिया में गैसीय मोलों की संख्या में परिवर्तन है।
गिब्स ऊर्जा में मानक परिवर्तन है
जी = - आर टीएलएन कपी,
जी टी = एच – टी एस.
समीकरणों के दाहिने हाथ की बराबरी करने के बाद:
- आर टीएलएन कपी = एच – टी एस
एलएन क आर = - एच / ( आर टी) + एस/ आर .
समीकरण न केवल तापमान पर स्थिरांक की निर्भरता के रूप को स्थापित करता है, बल्कि यह भी दर्शाता है कि स्थिरांक प्रतिक्रियाशील पदार्थों की प्रकृति से निर्धारित होता है।
संतुलन स्थिरांक एकाग्रता (साथ ही प्रतिक्रिया दर स्थिर), प्रतिक्रिया तंत्र, सक्रियण ऊर्जा और उत्प्रेरक की उपस्थिति पर निर्भर नहीं करता है. तंत्र को बदलना, उदाहरण के लिए, एक उत्प्रेरक की शुरूआत के साथ, संतुलन स्थिरांक के संख्यात्मक मूल्य को प्रभावित नहीं करता है, लेकिन निश्चित रूप से, उस दर को बदल देता है जिस पर संतुलन की स्थिति पहुंच जाती है।
रासायनिक संतुलन स्थिरांक
रासायनिक संतुलन की मात्रात्मक विशेषता है निरंतर संतुलन , जिसे संतुलन सांद्रता C i, आंशिक दबाव P i या अभिकारकों के मोल अंश X i के रूप में व्यक्त किया जा सकता है। कुछ प्रतिक्रिया के लिए
संगत संतुलन स्थिरांक निम्नानुसार व्यक्त किए जाते हैं:



संतुलन स्थिरांक प्रत्येक उत्क्रमणीय रासायनिक अभिक्रिया के लिए एक अभिलक्षणिक मान है; संतुलन स्थिरांक का मान केवल प्रतिक्रियाशील पदार्थों की प्रकृति और तापमान पर निर्भर करता है। एक आदर्श गैस के लिए अवस्था के समीकरण के आधार पर, संबंध P i = C i RT के रूप में लिखा जाता है, जहाँ C i = ni / V, और एक आदर्श गैस मिश्रण के लिए डाल्टन का नियम, समीकरण P = P i द्वारा व्यक्त किया जाता है। , हम i-वें घटक के आंशिक दबाव P i, दाढ़ सांद्रता C i और दाढ़ अंश X i के बीच संबंध प्राप्त कर सकते हैं:
![]()
यहाँ से हम K c, K p और K x के बीच संबंध प्राप्त करते हैं:
![]()
यहाँ Δν अभिक्रिया के दौरान गैसीय पदार्थों के मोलों की संख्या में परिवर्तन है:
= - 1 - 2 - ... + "1 + ν" 2 + ...
संतुलन स्थिरांक K x का मान, संतुलन स्थिरांक K c और K p के विपरीत, कुल दबाव P पर निर्भर करता है।
एक प्राथमिक प्रतिवर्ती प्रतिक्रिया के संतुलन स्थिरांक के लिए व्यंजक गतिज निरूपण से प्राप्त किया जा सकता है। आइए हम एक प्रणाली में संतुलन स्थापित करने की प्रक्रिया पर विचार करें जिसमें समय के प्रारंभिक क्षण में केवल प्रारंभिक पदार्थ मौजूद हों। इस समय आगे की प्रतिक्रिया वी 1 की गति अधिकतम है, और रिवर्स वी 2 की गति शून्य के बराबर है:
![]()
![]()
जैसे-जैसे प्रारंभिक सामग्री की सांद्रता कम होती जाती है, प्रतिक्रिया उत्पादों की सांद्रता बढ़ती जाती है; तदनुसार, आगे की प्रतिक्रिया की गति कम हो जाती है, रिवर्स प्रतिक्रिया की गति बढ़ जाती है। यह स्पष्ट है कि कुछ समय बाद आगे और पीछे की प्रतिक्रियाओं की दर समान हो जाएगी, जिसके बाद प्रतिक्रियाशील पदार्थों की सांद्रता में परिवर्तन नहीं होगा, अर्थात। रासायनिक संतुलन स्थापित होगा।
वी 1 = वी 2 लेते हुए, हम लिख सकते हैं:

इस प्रकार, संतुलन स्थिरांक आगे और पीछे की प्रतिक्रिया के दर स्थिरांक का अनुपात है। इसका तात्पर्य संतुलन स्थिरांक का भौतिक अर्थ है: यह दर्शाता है कि किसी दिए गए तापमान पर प्रत्यक्ष प्रतिक्रिया की दर कितनी बार रिवर्स की दर से अधिक है और सभी अभिकारकों की सांद्रता 1 mol / l के बराबर है। संतुलन स्थिरांक के लिए अभिव्यक्ति की उपरोक्त व्युत्पत्ति, आम तौर पर झूठे आधार से आगे बढ़ती है कि रासायनिक प्रतिक्रिया की दर सीधे स्टोइकोमेट्रिक गुणांक के बराबर शक्तियों में ली गई प्रतिक्रियाशील पदार्थों की सांद्रता के उत्पाद के समानुपाती होती है। जैसा कि ज्ञात है, सामान्य स्थिति में, रासायनिक प्रतिक्रिया के गतिज समीकरण में अभिकर्मकों की सांद्रता पर घातांक स्टोइकोमेट्रिक गुणांक के साथ मेल नहीं खाते हैं।
11. रेडॉक्स प्रतिक्रियाएं: परिभाषा, बुनियादी अवधारणाएं, ऑक्सीकरण और कमी का सार, प्रतिक्रिया के सबसे महत्वपूर्ण ऑक्सीकरण और कम करने वाले एजेंट।
रेडॉक्स कहलाते हैंऐसी प्रक्रियाएँ जो कुछ मुक्त या बाध्य परमाणुओं से इलेक्ट्रॉनों के विस्थापन के साथ होती हैं। चूंकि ऐसे मामलों में यह विस्थापन की डिग्री नहीं है, बल्कि केवल विस्थापित इलेक्ट्रॉनों की संख्या है, यह परंपरागत रूप से विस्थापन को हमेशा पूर्ण मानने और इलेक्ट्रॉनों के पीछे हटने या विस्थापन के बारे में बात करने के लिए प्रथागत है।
यदि किसी तत्व का परमाणु या आयन इलेक्ट्रॉन देता है या प्राप्त करता है, तो पहले मामले में, तत्व की ऑक्सीकरण अवस्था बढ़ जाती है और यह ऑक्सीकृत रूप (RF) में चली जाती है, और दूसरे में यह घट जाती है, और तत्व में चला जाता है कम फॉर्म (आरएफ)। दोनों रूप एक संयुग्मित रेडॉक्स जोड़ी बनाते हैं। प्रत्येक रेडॉक्स प्रतिक्रिया में दो संयुग्मित जोड़े शामिल होते हैं। उनमें से एक ऑक्सीकरण एजेंट के संक्रमण से मेल खाता है जो इलेक्ट्रॉनों को अपने कम रूप (ओएफ 1 → वीएफ 1) में स्वीकार करता है, और दूसरा एक कम करने वाले एजेंट के संक्रमण से मेल खाता है जो इलेक्ट्रॉनों को अपने ऑक्सीकरण रूप में दान करता है (वीएफ 2 → ओएफ 2 ), उदाहरण के लिए:
सीएल 2 + 2 आई - → 2 सीएल - + आई 2
ओएफ 1 डब्ल्यूएफ 1 डब्ल्यूएफ 2 ऑफ 2
(यहाँ Cl 2 एक ऑक्सीकारक है, I एक अपचायक है)
इस प्रकार, एक ही प्रतिक्रिया हमेशा एक साथ एक कम करने वाले एजेंट के ऑक्सीकरण की प्रक्रिया और एक ऑक्सीकरण एजेंट के अपचयन की प्रक्रिया होती है।
रेडॉक्स प्रतिक्रियाओं के समीकरणों में गुणांक पाया जा सकता है इलेक्ट्रॉनिक संतुलन के तरीकेऔर इलेक्ट्रॉन-आयन संतुलन। पहले मामले में, प्राप्त या दिए गए इलेक्ट्रॉनों की संख्या प्रारंभिक और अंतिम अवस्था में तत्वों के ऑक्सीकरण राज्यों में अंतर से निर्धारित होती है। उदाहरण:
एचएन 5+ ओ 3 + एच 2 एस 2– → एन 2+ ओ + एस + एच 2 ओ
इस प्रतिक्रिया में, दो तत्व ऑक्सीकरण अवस्था बदलते हैं: नाइट्रोजन और सल्फर। इलेक्ट्रॉनिक संतुलन समीकरण:
पृथक एच 2 एस अणुओं का अंश महत्वहीन है, इसलिए एस 2-आयन नहीं, बल्कि एच 2 एस अणु को समीकरण में प्रतिस्थापित किया जाता है। सबसे पहले, कणों का संतुलन बराबर किया जाता है। इस स्थिति में, एक अम्लीय माध्यम में, हाइड्रोजन आयनों को ऑक्सीकृत रूप में जोड़ा जाता है और पानी के अणुओं को कम रूप में जोड़ा जाता है जो समीकरण के लिए उपयोग किया जाता है। फिर आवेशों का संतुलन बराबर हो जाता है, और रेखा के दाईं ओर गुणांक होते हैं जो दिए गए और प्राप्त इलेक्ट्रॉनों की संख्या को बराबर करते हैं। उसके बाद, गुणांक को ध्यान में रखते हुए, सारांश समीकरण नीचे लिखा गया है:
एक संक्षिप्त आयन-आणविक समीकरण प्राप्त किया। इसमें Na + और K + आयनों को जोड़ने पर, हमें एक समान समीकरण पूर्ण रूप में मिलता है, साथ ही एक आणविक समीकरण भी:
NaNO 2 + 2 KMnO 4 + 2 KOH → NaNO 3 + 2 K 2 MnO 4 + H 2 O
एक तटस्थ माध्यम में, अर्ध-प्रतिक्रियाओं के बाईं ओर पानी के अणुओं को जोड़कर कणों का संतुलन बराबर किया जाता है, और एच + या ओएच-आयनों को दाईं ओर जोड़ा जाता है:
मैं 2 + सीएल 2 + एच 2 ओ → एचआईओ 3 + एचसीएल
प्रारंभिक सामग्री अम्ल या क्षार नहीं हैं; इसलिए, प्रतिक्रिया की प्रारंभिक अवधि में, समाधान में माध्यम तटस्थ के करीब है। अर्ध-प्रतिक्रिया समीकरण:
| मैं 2 + 6 एच 2 ओ + 10 ई → 2 आईओ 3 - + 12 एच + | |
| सीएल 2 + 2e → 2 सीएल - | |
| मैं 2 + 5 सीएल 2 + 6 एच 2 ओ → 2 आईओ 3 - + 12 एच + + 10 सीएल - |
आणविक रूप में प्रतिक्रिया समीकरण:
मैं 2 + 5 सीएल 2 + 6 एच 2 ओ → 2 एचआईओ 3 + 10 एचसीएल।
सबसे महत्वपूर्ण ऑक्सीडाइज़र और कम करने वाले एजेंट। कमी-कमी प्रतिक्रियाओं का वर्गीकरण
किसी तत्व के ऑक्सीकरण और अपचयन की सीमा को ऑक्सीकरण अवस्थाओं के अधिकतम और न्यूनतम मान * द्वारा व्यक्त किया जाता है। इन चरम अवस्थाओं में, आवर्त सारणी में स्थिति द्वारा निर्धारित, तत्व में केवल एक कार्य प्रकट करने की क्षमता होती है - एक ऑक्सीकरण एजेंट या एक कम करने वाला एजेंट। तदनुसार, इन ऑक्सीकरण अवस्थाओं में तत्व वाले पदार्थ केवल ऑक्सीकरण एजेंट (HNO 3, H 2 SO 4, HClO 4, KMnO 4, K 2 Cr 2 O 7, आदि) या केवल कम करने वाले एजेंट (NH 3, H 2 S) हैं। हाइड्रोजन हैलाइड, Na 2 S 2 O 3, आदि)। मध्यवर्ती ऑक्सीकरण अवस्था में तत्वों वाले पदार्थ ऑक्सीकरण और कम करने वाले एजेंट (एचसीएलओ, एच 2 ओ 2, एच 2 एसओ 3, आदि) दोनों हो सकते हैं।
रेडॉक्स प्रतिक्रियाओं को तीन मुख्य प्रकारों में विभाजित किया जाता है: इंटरमॉलिक्युलर, इंट्रामोल्युलर और अनुपातहीन प्रतिक्रियाएं।
पहले प्रकार में ऐसी प्रक्रियाएं शामिल हैं जिनमें ऑक्सीकरण तत्व के परमाणु और कम करने वाले तत्व विभिन्न अणुओं का हिस्सा होते हैं।
अंतराआण्विक अभिक्रियाएँ ऐसी अभिक्रियाएँ कहलाती हैं जिनमें एक ऑक्सीकारक और विभिन्न तत्वों के परमाणुओं के रूप में अपचायक एक ही अणु के भाग होते हैं। उदाहरण के लिए, समीकरण के अनुसार पोटेशियम क्लोरेट का थर्मल अपघटन:
2 KClO 3 → 2 KCl + 3 O 2
अनुपातहीन प्रतिक्रियाएं ऐसी प्रक्रियाएं हैं जिनमें ऑक्सीकरण और कम करने वाला एजेंट एक ही ऑक्सीकरण अवस्था में एक ही तत्व होता है, जो प्रतिक्रिया में घटता और बढ़ता है, उदाहरण के लिए:
3 एचसीएलओ → एचसीएलओ 3 + 2 एचसीएल
विपरीत अनुपातिक प्रतिक्रियाएं भी संभव हैं। इनमें इंट्रामोल्युलर प्रक्रियाएं शामिल हैं जिनमें ऑक्सीकरण और कम करने वाले एजेंट एक ही तत्व हैं, लेकिन विभिन्न ऑक्सीकरण राज्यों में परमाणुओं के रूप में और प्रतिक्रिया के परिणामस्वरूप इसे समतल करना, उदाहरण के लिए।
नए लेख
- पीआई क्या है और इसका क्या मतलब है?
- जन्मदिन के बारे में पूरा रहस्य
- नरक के राक्षसों के नामों की उत्पत्ति
- एक मृतक प्रियजन की आत्मा के साथ संचार
- शुक्र किस चीज से बनता है। शुक्र के बारे में संदेश। यह अन्य ग्रहों की तुलना में विपरीत दिशा में घूमता है।
- किसी व्यक्ति के जीवन और प्रतिष्ठा को कैसे खराब करें?
- आपको क्या ध्यान देना चाहिए
- जन्म तिथि के अनुसार राशिफल
- ताश खेलने पर सरल भाग्य बता रहा है - भविष्य और प्यार के लिए लेआउट
- ऑनलाइन ताश खेलने पर भाग्य बता रहा है
लोकप्रिय लेख
- दैनिक जीवन में पुरुषों, महिलाओं से, यौन रूप से, चुंबन के माध्यम से, रक्त के माध्यम से एचआईवी संक्रमण कैसे फैलता है
- क्लैमाइडिया के लिए हेलिकोबैक्टर पाइलोरी एंटीबॉडी के परीक्षण के परिणामों को कैसे समझें 1 5
- प्रोस्टेटाइटिस के उपचार में बर्डॉक रूट का उपयोग करना बर्डॉक के साथ प्रोस्टेट एडेनोमा का इलाज कैसे करें
- गोनोरिया का निदान पीसीआर विधि द्वारा गोनोरिया के विश्लेषण का नाम क्या है?
- हम घर पर जननांग मौसा का इलाज करते हैं मस्से को जलाएं
- गर्भाशय फाइब्रॉएड के इलाज में गर्भनिरोधक गोलियां क्यों उपयोगी हैं कोको लेने पर फाइब्रॉएड का क्या होगा?
- क्लैमाइडिया से वयस्क और बच्चे कैसे संक्रमित हो सकते हैं?
- महिलाओं में यूरियाप्लाज्मा के उपचार के लिए सपोसिटरी: यूरियाप्लाज्मा के उपचार के लिए वीफरॉन और जेनफेरॉन वीफरॉन सपोसिटरी
- बहुत मजबूत, विपुल, भयानक, भयानक थ्रश, क्या करें?
- सूजाक उत्तेजना के साथ धब्बा


