Výpočet rovnovážnej konštanty sústavy. chemická bilancia. chemická rovnovážna konštanta
Úloha 135.
Vypočítajte rovnovážnu konštantu pre homogénny systém
ak je rovnovážna koncentrácia reaktantov (mol/l):
[CO]P = 0,004; [H20]P = 0,064; [C02]P = 0,016; [H 2] p \u003d 0,016,
Aké sú počiatočné koncentrácie vody a CO? Odpoveď: K = 1; ref = 0,08 mol/l; [CO]ref = 0,02 mol/l.
rozhodnutie:
Reakčná rovnica je:
CO (g) + H20 (g) CO2 (g) + H2 (g)
Konštanta rovnice pre túto reakciu má výraz:
Na zistenie počiatočných koncentrácií látok H 2 O a CO berieme do úvahy, že podľa reakčnej rovnice z 1 mol CO a 1 mol H 2 O je 1 mol CO 2 a 1 mol H 2 tvorené. Pretože podľa podmienok problému sa v každom litri systému vytvorilo 0,016 mol CO 2 a 0,016 mol H 2, potom sa spotrebovalo 0,016 mol CO a H 2 O. Požadované počiatočné koncentrácie sú teda:
Ref \u003d [H20]P + 0,016 \u003d 0,004 + 0,016 \u003d 0,02 mol / l;
[CO] ref \u003d [CO] P + 0,016 \u003d 0,064 + 0,016 \u003d 0,08 mol / l.
odpoveď: Kp = 1; ref = 0,08 mol/l; [CO] ref = 0,02 mol/l.
Úloha 136.
Rovnovážna konštanta homogénneho systému
pri určitej teplote sa rovná 1. Vypočítajte rovnovážne koncentrácie všetkých reagujúcich látok, ak sú počiatočné koncentrácie rovnaké (mol/l): [CO] ref = 0,10; [H20] ref = 0,40.
Odpoveď: [CO2] P \u003d [H2] P \u003d 0,08; [CO]P = 0,02; [H20] P = 0,32.
rozhodnutie:
Reakčná rovnica je:
CO (g) + H20 (g) CO2 (g) + H2 (g)
V rovnováhe sú rýchlosti priamych a spätných reakcií rovnaké a pomer konštánt týchto rýchlostí je konštantný a nazýva sa rovnovážna konštanta daného systému:

Rovnovážnu koncentráciu jedného z produktov reakcie označujeme x mol / l, potom rovnovážna koncentrácia druhého bude tiež x mol / l, pretože oba vznikajú v rovnakom množstve. Rovnovážne koncentrácie východiskových látok budú:
[CO] ref = 0,10 – x mol/l; [H20] ref = 0,40 - x mol/l. (keďže pri vzniku x mol / l reakčného produktu sa spotrebuje, resp. x mol / l CO a H 2 O. V momente rovnováhy bude koncentrácia všetkých látok (mol / l): [CO 2 ] P = [H2] P = x; [CO] P = 0,10 - x; [H20] P = 0,4 - x.
Tieto hodnoty dosadíme do výrazu pre rovnovážnu konštantu:
![]()
Pri riešení rovnice zistíme, že x = 0,08. Preto rovnováha koncentrácie (mol/l):
[C02]P = [H2]P = x = 0,08 mol/l;
[H20] P \u003d 0,4 - x \u003d 0,4 - 0,08 \u003d 0,32 mol / l;
[CO] P \u003d 0,10 - x \u003d 0,10 - 0,08 \u003d 0,02 mol / l.
Úloha 137.
Rovnovážna konštanta homogénneho systému N2 + 3H2 \u003d 2NH3 pri určitej teplote je 0,1. Rovnovážne koncentrácie vodíka sú 0,2 mol/l a amoniaku 0,08 mol/l. Vypočítajte rovnovážne a počiatočné koncentrácie dusíka. Odpoveď: P = 8 mólov/l; ref = 8,04 mol/l.
rozhodnutie:
Reakčná rovnica je:
N2 + ZN2 \u003d 2NH3
Označme rovnovážnu koncentráciu N2 ako x mol/L. Výraz pre rovnovážnu konštantu tejto reakcie je:

Dosadíme údaje úlohy do vyjadrenia rovnovážnej konštanty a nájdeme koncentráciu N 2

Na zistenie počiatočnej koncentrácie N 2 berieme do úvahy, že podľa reakčnej rovnice na tvorbu 1 mólu NH 3 sa spotrebuje ½ mólu N 2 . Keďže podľa stavu problému v každom litri systému vzniklo 0,08 mol NH 3, 0,08 . 1/2 \u003d 0,04 mol N2. Požadovaná počiatočná koncentrácia N2 sa teda rovná:
Ref \u003d P + 0,04 \u003d 8 + 0,04 \u003d 8,04 mol / l.
odpoveď: P = 8 mol/l; ref = 8,04 mol/l.
Úloha 138
Pri určitej teplote rovnováha homogénneho systému
2NO + O 2 ↔ 2NO 2 bol stanovený pri nasledujúcich koncentráciách reaktantov (mol/l): p = 0,2; [02]p = 0,1; p = 0,1. Vypočítajte rovnovážnu konštantu a počiatočnú koncentráciu NO a O 2 . Odpoveď: K = 2,5; ref = 0,3 mol/l; [02] ex x = 0,15 mol/l.
rozhodnutie:
Reakčná rovnica:
2NO + O 2 ↔ 2 NO 2

Na zistenie počiatočných koncentrácií NO a O 2 berieme do úvahy, že podľa reakčnej rovnice z 2 mólov NO a 1 mólu O2 vzniknú 2 mol NO 2, potom sa spotrebovalo 0,1 mol NO a 0,05 mol O 2. Počiatočné koncentrácie NO a O2 sú teda rovnaké:
Ref = NO] p + 0,1 = 0,2 + 0,1 = 0,3 mol/l;
[02] ref \u003d [02] p + 0,05 \u003d 0,1 + 0,05 \u003d 0,15 mol / l.
odpoveď: Kp = 2,5; ref = 0,3 mol/l; [02] ref = 0,15 mol/l.
Úloha 139.
Prečo sa pri zmene tlaku posúva rovnováha systému?
N 2 + 3Н 2 ↔ 2NH 3 a rovnováha systému N 2 + O 2 2NO sa neposúva? Svoju odpoveď zdôvodnite na základe výpočtu rýchlosti dopredných a spätných reakcií v týchto systémoch pred a po zmene tlaku. Napíšte výrazy pre rovnovážne konštanty každého z týchto systémov.
rozhodnutie:
a) Reakčná rovnica:
N2 + 3H2↔2NH3.
Z reakčnej rovnice vyplýva, že reakcia prebieha pri zmenšovaní objemu v sústave (zo 4 mólov plynných látok vznikajú 2 móly plynnej látky). Preto so zmenou tlaku v systéme bude pozorovaný posun v rovnováhe. Ak sa tlak v tomto systéme zvýši, potom sa podľa Le Chatelierovho princípu rovnováha posunie doprava, smerom k zníženiu objemu. Keď sa rovnováha v systéme posunie doprava, rýchlosť priamej reakcie bude väčšia ako rýchlosť spätnej reakcie:
pr>arr alebo pr \u003d k 3\u003e o br \u003d k 2.
Ak sa tlak v systéme zníži, potom sa rovnováha systému posunie doľava v smere zväčšujúceho sa objemu, potom keď sa rovnováha posunie doľava, rýchlosť priamej reakcie bude menšia ako rýchlosť ten priamy:
atď< обр или (пр = k 3 )< (обр = k 2).
b) Reakčná rovnica:
N2 + O2) ↔ 2NO. .
Z reakčnej rovnice vyplýva, že keď reakciu nesprevádza zmena objemu, reakcia prebieha bez zmeny počtu mólov plynných látok. Preto zmena tlaku v systéme nepovedie k posunu v rovnováhe, takže rýchlosti priamych a spätných reakcií budú rovnaké:
pr \u003d arr \u003d alebo (pr k [O 2]) \u003d (arr \u003d k 2) .
Úloha 140.
Počiatočné koncentrácie ref a [С1 2 ]ref v homogénnom systéme
2NO + Cl 2 ↔ 2NOС1 sú 0,5 a 0,2 mol/l. Vypočítajte rovnovážnu konštantu, ak do dosiahnutia rovnováhy reagovalo 20 % NO. Odpoveď: 0,417.
rozhodnutie:
Reakčná rovnica je: 2NO + Cl 2 ↔ 2NOС1
Podľa stavu problému vstúpilo do reakcie 20% NO, čo je 0,5 .
0,2 = 0,1 mol, ale 0,5 - 0,1 = 0,4 mol NO nereagovalo. Z reakčnej rovnice vyplýva, že na každé 2 móly NO sa spotrebuje 1 mól Cl2 a tvoria sa 2 móly NOCl. Preto 0,05 mol Cl 2 reagovalo s 0,1 mol NO a vzniklo 0,1 mol NOCl. 0,15 mol Cl2 zostalo nevyužitých (0,2 - 0,05 = 0,15). Rovnovážne koncentrácie príslušných látok sú teda rovnaké (mol / l):
P = 0,4; p = 0,15; p = 0,1.
Rovnovážna konštanta tejto reakcie je vyjadrená rovnicou:
![]()
Dosadením do tohto výrazu rovnovážne koncentrácie látok získame.
CHEMICKÁ ROVNOVÁHA. KONŠTANTA CHEMICKEJ ROVNOVÁHY
Príklad 1. Vypočítajte zmenu Gibbsovej energie ΔG pri reakcii dimerizácie oxidu dusičitého 2NO 2 (g) = N 2 O 4 (g) pri štandardnej teplote 298 K, 273 K a 373 K. Urobte záver o smere proces. Stanovte rovnovážne konštanty dimerizačnej reakcie oxidu dusičitého pri vyššie uvedených teplotách. Určte teplotu, pri ktorej Δ G = 0. Urobte záver o smere tejto reakcie nad a pod touto teplotou. Termodynamické vlastnosti komponentov:
ΔΗ° 298 S o 298
V-in kJ/mol J/mol*K
N02 (g) 33,3 240,2
N204 (g) 9,6 303,8
rozhodnutie. Pre reverzibilný proces:
aA (d) + bB (d) ⇄ cc (d) + dD (d)
výraz pre rovnovážnu konštantu K p bude
Kp \u003d (P c C * P d D) / (P a A * P b B)
kde P A, P B, P C, P D - rovnovážne parciálne tlaky plynných zložiek A, B, C, D a, b, c, d - stechiometrické koeficienty.
Pre proces aA (g) + bB (w) ⇄ s C(g) +dD (g) vyjadrenie pre rovnovážnu konštantu
Kc = (C c C *C d D)/(C a A *C b B)
kde C A, C B, C C, C D - rovnovážne koncentrácie látok A, B, C, D a, b, c, d - stechiometrické koeficienty.
Podľa vzorca (1.4.1) pre systém 2NO 2 ⇄ N 2 O 4 máme
Kp \u003d PN204/P2NO2
Pri štandardnej teplote 298 K je zmena entalpie (ΔH o reakcie) určená vzorcom (1.2.2)
ΔHo reakcia \u003d ΔΗ ° 298 N204 - 2ΔΗ ° 298 NO2 \u003d 9,6-2 * 33,5 \u003d -57400 J.
Zmena entropie (1.3.5)
ΔS o reakcia \u003d S ° 298 N2O4 - 2S ° 298 NO2 \u003d 303,8-2 * (240,2) \u003d -176 J / mol * K
Pomocou Le Chatelierovho princípu, ktorý hovorí, že pri zmene podmienok, za ktorých je vratná reakcia v rovnováhe, sa rovnováha posunie smerom k procesu zoslabnutia zmeny, predpovedáme smer posunu rovnováhy. Hodnota ΔΗ asi je záporná, preto je reakcia tvorby exotermická (prebieha s uvoľňovaním tepla) a s poklesom teploty by sa rovnováha mala posunúť doprava a so zvýšením teploty doľava. Okrem toho, podľa vzorca (1.3.6), s vedomím, že ΔH
ΔGo 273; ΔGo 298; AGo 373 a K273; K298; K 373
Hodnota Gibbsovej energie pre dané teploty sa vypočíta podľa vzorca (1.3.7):
ΔG o 298 \u003d ΔH o -TAS o \u003d -57400-298 * (-176) \u003d -4952 J.,
ΔG o 273 \u003d -57400-273 * (-176) \u003d -9352J:
ΔG o 373 \u003d -57400-373 * (-176) \u003d 7129 J.
Záporná hodnota AG o 298 indikuje posun reakčnej rovnováhy doprava a vyššia záporná hodnota AG o 273 znamená, že keď teplota klesá z (298 na 273 K), rovnováha sa posúva doprava.
Kladná hodnota ΔG o 373 indikuje zmenu smeru spontánneho procesu. Pri tejto teplote sa stáva výhodnejšou reverzná reakcia (posun rovnováhy doľava).
Rovnovážne konštanty K p a Gibbsova energia ΔG o súvisia podľa vzorca
kde Kp je rovnovážna konštanta procesu; R je plynová konštanta; T je absolútna teplota. Podľa vzorca (1.4.3) máme:
lnK 273 \u003d - ΔG o 273 /RT \u003d 9352 / 8,31 * 273 \u003d 4,12
lnK 298 \u003d -ΔG o 298 / RT \u003d 4952 / 8,31 * 298 \u003d 2
lnK 373 \u003d -ΔG o 373 / RT \u003d -7129 / 8,31 * 298 \u003d -2,3
hodnota K 298 a K 273 > 1 naznačuje posun rovnováhy doprava (porovnaj s (1.4.1)) a čím viac, tým vyššia je hodnota rovnovážnej konštanty. K 373< 1, говорит ο смещении равновесия в системе влево (сравни с (1.4.1)).
Podmienka ΔG o reakcia =0 zodpovedá rovnovážnej konštante,
rovný jednej.
Vypočítajte teplotu T zodpovedajúcu tejto konštante podľa vzorca (1.3.7):
AG°=AΗ°-TASo; 0=AHo-TASo;
T Δ G = 0 = ΔΗ°/ΔS° = 57400/176=326,19 K
Záver. Pri teplote 326,19 K prebiehajú dopredné a spätné reakcie s rovnakou pravdepodobnosťou, K p =1. Keď teplota klesá, rovnováha sa posunie doprava a doľava, keď teplota stúpa.
Príklad 2. Rovnovážna konštanta Kp reakcie syntézy NH3 reakciou N 2+3 H2 \u003d\u003d 2NH3 pri 623 K je 2,32 * 10 -13. Vypočítajte Kc pri rovnakej teplote.
rozhodnutie. Komunikácia Kp a K sa uskutočňuje podľa vzorca
Kp = Kc (RT) Δn, (1.4.4)
Δn= n 2 - n 1 \u003d 2-4 \u003d -2, kde n 1 a n 2 sú počet mólov činidiel a produktov. teda
Kc \u003d Kp / (RT) Δ n \u003d 0,624 * 10 -5
Odpoveď. K \u003d 0,624 * 10 -5.
Príklad 2 Disociačná elasticita uhličitanu vápenatého pri 1154 K je 80380 Pa a pri 1164 K je 91177 Pa. Vypočítajte, pri akej teplote bude elasticita disociácie uhličitanu vápenatého rovná 101325 Pa.
rozhodnutie. Disociačná reakcia CaCO 3 (cr) ⇄ CaO (cr) + CO 2 (g)
Preto podľa (1.4.1)
Kp \u003d P CO2
Preto pri každej teplote (T1 - 1154 K; Τ \u003d 1164 K * Τ \u003d X) budú rovnovážne konštanty zodpovedať tlaku:
Kti = 80380; KT2 = 91177; KT3 = 101325.
Závislosť rovnovážnej konštanty od teploty ukazuje Arrheniova rovnica
dlnK p /dT= ΔΗ/RT 2 (1.4.5)
kde Kp je rovnovážna konštanta; Τ - teplota, K; ΔΗ je tepelný účinok reakcie; R je plynová konštanta.
Integráciou rovnice (1.4.5) v teplotnom rozsahu T 1 -T 2 pri Δ H= konšt.
lnK T 1 /K T 2 \u003d ΔΗ / R (1 / T 1 -1 / T 2),
Kde KT1 a KT 2 sú rovnovážne konštanty pri T1 a T2.
Najprv určme ΔH (podľa 1.4.6)
ΔΗ=ln(91177*8,31*1154*1164/80380*10)=140500 J/mol.
ln(101325/91177)=140500/8,31(1/1164-1/T 3)
T 3 \u003d 1172 K
Odpoveď. Pri T=1172K bude elasticita disociácie uhličitanu vápenatého rovná 101325 Pa.
Úlohy
56. Disociačná konštanta kyseliny octovej pri 298 K je 1,75 x 10-5. Aká je zmena Gibbsovej energie disociácie kyseliny octovej?
57. Nájdite hodnotu Gibbsovej energie (ΔG o 298) a rovnovážnu konštantu K 298 pre reakciu BaSO 4 (cr) → Ba 2+ (p) + SO 2- 4 (p).
Na výpočet použite nasledujúce údaje:
Látka S o 298 J / mol * K ΔH o 298 kJ / mol 2 ^ 2 ^
BaS04 (cr) 132,4 - 1447,39
Ba2+ (p) 9,64 -533,83
SO 2-4 (p) 18,44 - 904,2.
58. Nájdite rovnovážnu konštantu pri 473 K pre reakciu hydratácie etylénu
C2H4 (g) + H20 (g) \u003d C2H50H (g).
Zvážte vlastnosti činidiel v tabuľke. 3. Ignorujte závislosť ΔS a ΔH od teploty.
59. Za predpokladu, že ∆Ho 298 a ∆S asi 298 reakcie 4HCl + O 2 ⇄ 2H 2 O + 2Cl 2 nezávisia od teploty, nájdite teplotu, pri ktorej
Kp \u003d 1 a AG o = O.
60. Pomocou tabuľkových údajov vypočítajte rovnovážne konštanty nasledujúcich reakcií pri 298 K a pri 1000 K:
a) H20 (g) + CO ⇄ CO2 + H2
b) C02 + C (gr) ⇄ 2SO;
c) N2 + 3H2⇄2NH3.
Ignorujte zmeny ΔH o a S o od teploty.
61. Pre nejakú spontánnu reakciu Δ S< О. Как будет изменяться константа равновесия с повышением температуры: а) увеличиваться, б) уменьшаться, в) по данным задачи нельзя определить.
62. Bez použitia výpočtov nastavte znamienko ΔS o nasledujúcich procesov:
a) 2NH3 (g) ⇄N2 (g) + H2 (g);
b) C02 (cr) ⇄ C02 (g);
c) 2NO (g) + 02 (g) = 2N02 (g);
d) 2H2S (g) + 302 \u003d 2H20 (g) + 2S02 (g);
e) 2CH30H (g) + 302 (g) \u003d 4H20 (g) + 2C02 (g).
63. V ktorom z nasledujúcich prípadov je možná reakcia pri akejkoľvek teplote: a) ΔH°< 0, ΔS°>0; b) AH°<0, ΔS°<0; в) Δ Н°>0, ∆S°> 0 ?
64. V ktorom z nasledujúcich prípadov je reakcia nemožná pri akejkoľvek teplote: a) ΔН°> 0, ΔS°> 0; b) Δ H°>0, AS°<0; в) Δ Н°<0, ΔS°<0 ?
65. Ak ΔΗ°<0 и ΔS°<0 ,
V ktorom z nasledujúcich prípadov môže reakcia prebiehať spontánne?
a) | ΔH°| > |TAS°|; b)| ΔH°| > |TΔS°| ?
66. Aké účinky na systém môžu posunúť rovnováhu systémov:
a) N2 (g) + 3H2 (g) = 2NH3 (g);
b) 4Fe (cr) + 302 (g) ⇄ 2Fe203 (cr);
c) S02 (g) + 02 (g) ⇄ 2S03 (g).
67. Ktorým smerom sa posunie rovnováha so zvýšením teploty v systémoch:
1) COCI2⇄ CO + Cl2; ΔН°=113 kJ;
2) 2SO ⇄ CO2 + C; ΔН°=-171 kJ;
3) 2SO3⇄2S02 + O2; ΔН° = 192 kJ.
68. Ktorým smerom sa bude posúvať rovnováha so zvyšujúcim sa tlakom v systémoch:
1) H2 (g) + S (cr) ⇄ H2S (g);
2) 2CO (g) ⇄ CO2 (g) + C (g);
3) 4HCI (g) + 02 (g) ⇄ 2H20 (g) + 2C12 (g).
69. Ako to ovplyvní rovnováhu nasledujúcich reakcií:
CaC03 (cr) ⇄ CaO (cr) + C02 (g); ΔН°=178 kJ;
2CO (g) + 02 (g) ⇄ 2C02; ΔН°=-566 kJ;
N2 (g) + 02 (g) ⇄ 2NO (g); ΔН° = 180 kJ.
a) zvýšenie teploty
b) zvýšenie tlaku?
70. Pomocou referenčných údajov nájdite približnú hodnotu teploty, pri ktorej je rovnovážna konštanta reakcie tvorby vodného plynu.
C (g) + H20 (g) ⇄ CO (g) + H2 (g)
rovná 1. Ignorujte závislosť ΔH o a S o od teploty.
71. Rovnovážna konštanta Kp reakcie CO + Cl 2 ⇄ COCl 2 pri 600 o C je 1,67 * 10 -6. Vypočítajte K z reakcie pri danej teplote.
72. Elasticita disociácie uhličitanu horečnatého pri 1000 K je 42189 Pa a pri 1020 K - 80313 Pa. Určte tepelný účinok reakcie MgCO 3 ⇄ MgO + CO 2 a teplotu, pri ktorej sa elasticita disociácie uhličitanu horečnatého rovná 1 Pa.
Chemická rovnováha je stav reverzibilnej chemickej reakcie
aA + b B= c C+ d D,
pri ktorej v priebehu času nedochádza k zmene koncentrácií reaktantov v reakčnej zmesi. Charakterizuje sa stav chemickej rovnováhy chemická rovnovážna konštanta:
kde C i sú koncentrácie zložiek v rovnováha perfektná zmes.
Rovnovážnu konštantu možno vyjadriť aj ako rovnovážne mólové zlomky X i komponenty:
Pre reakcie prebiehajúce v plynnej fáze je vhodné vyjadriť rovnovážnu konštantu pomocou rovnovážnych parciálnych tlakov Pi komponenty:
Pre ideálne plyny Pi = C i RT a Pi = X i P, kde P je celkový tlak, tak KP, K C a K X súvisia nasledujúcim vzťahom:
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
Rovnovážna konštanta súvisí s rG o chemická reakcia:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Zmeniť rG alebo r F v chemickej reakcii pri daných (nie nevyhnutne rovnovážnych) parciálnych tlakoch Pi alebo koncentrácie C i zložky možno vypočítať pomocou rovnice izotermy chemických reakcií (van't Hoffove izotermy):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Podľa princíp Le Chatelier Ak na systém v rovnováhe pôsobí vonkajšia sila, potom sa rovnováha posunie tak, že sa zníži účinok vonkajšej sily. Zvýšenie tlaku teda posúva rovnováhu v smere poklesu počtu molekúl plynu. Prídavok reakčnej zložky do rovnovážnej zmesi posúva rovnováhu v smere znižovania množstva tejto zložky. Zvýšenie (alebo zníženie) teploty posúva rovnováhu v smere reakcie prebiehajúcej absorpciou (uvoľňovaním) tepla.
Kvantitatívne je závislosť rovnovážnej konštanty od teploty opísaná rovnicou izobary chemickej reakcie (van't Hoffove izobary)
![]() (9.9)
(9.9)
a izochóry chemickej reakcie (van't Hoffove izochory)
![]() . (9.10)
. (9.10)
Integrácia rovnice (9.9) za predpokladu, že r H reakcia nezávisí od teploty (čo platí v úzkych teplotných rozsahoch), dáva:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
kde C- integračná konštanta. Teda závislosť ln K P od 1 /T musí byť lineárny a sklon priamky je - r H/R.
Integrácia v rámci K 1 , K 2 a T 1, T 2 dáva:
 (9.13)
(9.13)
 (9.14)
(9.14)
Pomocou tejto rovnice, poznáme rovnovážne konštanty pri dvoch rôznych teplotách, môžeme vypočítať r H reakcie. Podľa toho vedieť r H reakcie a rovnovážnej konštanty pri jednej teplote, môžete vypočítať rovnovážnu konštantu pri inej teplote.
PRÍKLADY
CO (g) + 2H2 (g) \u003d CH30H (g)
na 500 tis. f G o pre CO(g) a CH30H(g) pri 500 K sú –155,41 kJ. mol –1 a –134,20 kJ. mol –1, resp.
rozhodnutie. Choď reakcie:
r G o= f G o(CH3OH) - f G o(CO) = –134,20 – (–155,41) = 21,21 kJ. mol-1.
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Príklad 9-2. Reakčná rovnovážna konštanta
rovná sa K P = 1,64 10 –4 pri 400 o C. Aký celkový tlak musí byť aplikovaný na ekvimolárnu zmes N 2 a H 2 , aby sa 10 % N 2 premenilo na NH 3 ? Predpokladá sa, že plyny sú ideálne.
rozhodnutie. Nechajte reagovať mol N 2. Potom
| N2 (g) | + | 3H 2 (g) | = | 2NH3 (g) | |
| Počiatočné množstvo | 1 | 1 | |||
| Rovnovážne množstvo | 1– | 1–3 | 2 (Celkovo: 2 – 2) | ||
| Rovnovážny molárny zlomok: |
teda K X= 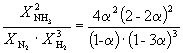 a KP = KX. P –2
=
a KP = KX. P –2
=  .
.
Dosadením = 0,1 do výsledného vzorca máme
1.64 10 –4 = , kde P= 51,2 atm.
, kde P= 51,2 atm.
Príklad 9-3. Reakčná rovnovážna konštanta
CO (g) + 2H2 (g) \u003d CH30H (g)
pri 500 K je K P = 6,0910–3. Reakčná zmes pozostávajúca z 1 mol CO, 2 mol H2 a 1 mol inertného plynu (N2) sa zahreje na 500 K a celkový tlak 100 atm. Vypočítajte zloženie rovnovážnej zmesi.
rozhodnutie. Nechajte reagovať mol CO2. Potom
| CO(g) | + | 2 h 2 (g) | = | CH30H (g) | |
| Počiatočná suma: | 1 | 2 | 0 | ||
| Rovnovážne množstvo: | 1– | 2–2 | |||
| Celkom v rovnovážnej zmesi: | 3–2 molové zložky + 1 mol N 2 \u003d 4–2 mol | ||||
| Rovnovážny molárny zlomok | |||||
teda K X=  a KP = KX. P-2 =
a KP = KX. P-2 = ![]() .
.
Teda 6,09 10 –3 = ![]() .
.
Vyriešením tejto rovnice dostaneme = 0,732. V súlade s tým sú molárne frakcie látok v rovnovážnej zmesi: = 0,288, = 0,106, = 0,212 a = 0,394.
Príklad 9-4. Na reakciu
N2 (g) + 3H2 (g) \u003d 2NH3 (g)
na 298 K K P = 6,0105 a f H o(NH 3) \u003d -46,1 kJ. mol-1. Odhadnite hodnotu rovnovážnej konštanty pri 500 K.
rozhodnutie. Štandardná molárna entalpia reakcie je
r H o= 2f H o(NH 3) \u003d -92,2 kJ. mol-1.
Podľa rovnice (9.14)  =
=
Ln (6,0 10 5) + ![]() = –1,73, odkiaľ K 2 =
0.18.
= –1,73, odkiaľ K 2 =
0.18.
Všimnite si, že rovnovážna konštanta exotermickej reakcie so zvyšujúcou sa teplotou klesá, čo zodpovedá Le Chatelierovmu princípu.
ÚLOHY
- Pri 1273 K a celkovom tlaku 30 atm v rovnovážnej zmesi
- Pri 2000 o C a celkovom tlaku 1 atm sa 2 % vody disociujú na vodík a kyslík. Vypočítajte rovnovážnu konštantu reakcie
- Reakčná rovnovážna konštanta
- Reakčná rovnovážna konštanta
- 3-litrová nádoba obsahujúca 1,7910–2 mol I2 sa zahriala na 973 K. Tlak v nádobe pri rovnováhe bol 0,49 atm. Za predpokladu ideálnych plynov vypočítajte pre reakciu rovnovážnu konštantu pri 973 K
- Na reakciu
- Na reakciu
- 1-litrová nádoba obsahujúca 0,341 mol PCl 5 a 0,233 mol N 2 sa zahriala na 250 °C. Celkový tlak v nádobe pri rovnováhe bol 29,33 atm. Vzhľadom na to, že všetky plyny sú ideálne, vypočítajte rovnovážnu konštantu pri 250 o C pre reakciu prebiehajúcu v nádobe
- Reakčná rovnovážna konštanta
- Pri 25°C f G o(NH 3) = –16,5 kJ. mol-1. Vypočítajte rG reakcie tvorby NH3 pri parciálnych tlakoch N2, H2 a NH3 rovných 3 atm, 1 atm a 4 atm, v tomto poradí. Akým smerom bude reakcia prebiehať spontánne za týchto podmienok?
- exotermická reakcia
- Rovnovážna konštanta izomerizačnej reakcie borneolu (C10H17OH) na izoborneol v plynnej fáze je 0,106 pri 503 K. Zmes 7,5 g borneolu a 14,0 g izoborneolu sa umiestnila do 5 1 nádoby a udržiavala sa pri 503 K, kým sa nedosiahla rovnováha. . Vypočítajte mólové frakcie a hmotnosti borneolu a izoborneolu v rovnovážnej zmesi.
- Rovnováha v reakcii
- Vypočítajte celkový tlak, ktorý sa musí použiť na zmes 3 dielov H 2 a 1 dielu N 2, aby sa získala rovnovážna zmes obsahujúca 10 % objemových NH 3 pri 400 o C. Rovnovážna konštanta pre reakciu
- Pri 250 o C a celkovom tlaku 1 atm sa PCl 5 disociuje o 80 % podľa reakcie
- Pri 2000 °C na reakciu
- Vypočítajte štandardnú entalpiu reakcie, pre ktorú je rovnovážna konštanta
a) sa zvýši 2-krát, b) sa zníži 2-krát pri zmene teploty z 298 K na 308 K. - Závislosť rovnovážnej konštanty reakcie 2C3H6 (g) \u003d C2H4 (g) + C4H8 (g) od teploty medzi 300 K a 600 K je opísaná rovnicou
CO2 (g) + C (tv) \u003d 2CO (g)
obsahuje 17 % (objemových) C02. Koľko percent CO 2 bude obsiahnutých v plyne pri celkovom tlaku 20 atm? Pri akom tlaku bude plyn obsahovať 25 % CO 2 ?
H20 (g) \u003d H2 (g) + 1/202 (g) za týchto podmienok.
CO (g) + H20 (g) \u003d CO2 (g) + H2 (g)
pri 500 o C je Kp= 5,5. Zmes 1 mol CO a 5 mol H20 sa zahriala na túto teplotu. Vypočítajte molárny zlomok H 2 O v rovnovážnej zmesi.
N2O4 (g) \u003d 2N02 (g)
pri 25 o C je Kp= 0,143. Vypočítajte tlak, ktorý sa vytvorí v 1litrovej nádobe, do ktorej je pri tejto teplote umiestnený 1 g N 2 O 4 .
I2(g) = 2I (g).
pri 250°C rG o \u003d -2508 J. mol -1. Pri akom celkovom tlaku bude stupeň premeny PCl 5 na PCl 3 a Cl 2 pri 250 o C 30 %?
2HI (g) \u003d H2 (g) + I2 (g)
rovnovážna konštanta K P = 1,83 10 –2 pri 698,6 K. Koľko gramov HI vznikne, keď sa 10 g I 2 a 0,2 g H 2 zahreje na túto teplotu v trojlitrovej nádobe? Aké sú parciálne tlaky H 2 , I 2 a HI?
PCl5 (g) = PCl3 (g) + Cl2 (g)
CO (g) + 2H2 (g) \u003d CH30H (g)
pri 500 K je K P = 6,0910–3. Vypočítajte celkový tlak potrebný na výrobu metanolu s 90 % výťažkom, ak sa CO a H2 odoberú v pomere 1:2.
CO (g) + 2H2 (g) \u003d CH30H (g)
je v rovnováhe pri 500 K a 10 baroch. Ak sú plyny ideálne, ako ovplyvnia výťažok metanolu nasledujúce faktory: a) rastúce T; b) propagácia P; c) pridanie inertného plynu pri V= konštanta; d) pridanie inertného plynu pri P= konštanta; e) pridanie H2 at P= konštanta?
2NOCl (g) \u003d 2NO (g) + Cl2 (g)
nastavená na 227 o C a celkový tlak 1,0 bar, kedy parciálny tlak NOCl je rovný 0,64 bar (na začiatku bol prítomný len NOCl). Vypočítajte r G o za reakciu. Pri akom celkovom tlaku bude parciálny tlak Cl 2 0,10 bar?
N2 (g) + 3H2 (g) \u003d 2NH3 (g)
pri 400 o C je K = 1.60 10 –4 .
PCI5 (g) = PCI3 (g) + Cl2 (g).
Aký bude stupeň disociácie PCl 5, ak sa do systému pridá N 2 tak, aby parciálny tlak dusíka bol 0,9 atm? Celkový tlak sa udržiava na 1 atm.
N2 (g) + O2 (g) \u003d 2NO (g)
Kp = 2,510–3. Rovnovážna zmes N2, O2, NO a inertného plynu pri celkovom tlaku 1 bar obsahuje 80 % (objemových) N2 a 16 % O2. Koľko percent objemu je NIE? Aký je parciálny tlak inertného plynu?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Študijné otázky
Stav rovnováhy
Rovnovážna konštanta
Výpočet rovnovážnych koncentrácií
Posun v chemickej rovnováhe. Le Chatelierov princíp
Stav rovnováhy
Reakcie, ktoré prebiehajú za rovnakých podmienok súčasne v opačných smeroch, sa nazývajú reverzibilné..
Uvažujme o reverzibilnej reakcii, ktorá prebieha v uzavretom systéme
Rýchlosť priamej reakcie je opísaná rovnicou:
 pr = k pr [A] [B],
pr = k pr [A] [B],
kde  pr je rýchlosť priamej reakcie;
pr je rýchlosť priamej reakcie;
k pr je rýchlostná konštanta priamej reakcie.
V priebehu času sa koncentrácie činidiel ALE a AT pokles, rýchlosť reakcie klesá (obr. 1, krivka  atď).
atď).
Reakcia medzi ALE a AT vedie k tvorbe látok C a D, ktorej molekuly pri zrážkach môžu opäť dávať látky ALE a AT.
Rýchlosť reverznej reakcie je opísaná rovnicou:
 arr = k
arr [C] [D],
arr = k
arr [C] [D],
kde  arr je rýchlosť reverznej reakcie;
arr je rýchlosť reverznej reakcie;
k arr je rýchlostná konštanta reverznej reakcie.
Ako koncentrácie látok C a D zvýšenie, rýchlosť spätnej reakcie sa zvýši (obr. 1, krivka  arr).
arr).

Obr.1. Zmena rýchlosti priamych a spätných reakcií v čase
Postupom času rýchlosti doprednej a spätnej reakcie sa rovnajú:
 pr =
pr =  arr
arr
Tento stav systému sa nazýva rovnovážny stav .
V rovnovážnom stave sa koncentrácie všetkých jeho účastníkov v čase prestávajú meniť . Takéto koncentrácie sa nazývajú vyvážené .
Chemická rovnováha – Toto dynamická rovnováha. Stálosť koncentrácií látok prítomných v uzavretom systéme je dôsledkom neustále prebiehajúcich chemických procesov. Rýchlosti priamych a spätných reakcií sa nerovnajú nule, ale pozorovaná rýchlosť procesu sa rovná nule.
Rovnosť rýchlostí priamych a spätných reakcií je kinetickou podmienkou chemickej rovnováhy.
2. Rovnovážna konštanta
Keď sú rýchlosti priamych a spätných reakcií rovnaké
 pr =
pr =  arr
arr
spravodlivá rovnosť
k pr [A] [B] = k arr [C] [D],
kde [ A], [B], [S], [D] sú rovnovážne koncentrácie látok.
Keďže rýchlostné konštanty nezávisia od koncentrácií, rovnosť možno zapísať inak:

Pomer rýchlostných konštánt doprednej a spätnej reakcie ( k atď / k arr ) sa nazýva konštanta chemickej rovnováhy:
|
|
Skutočnú chemickú rovnováhu možno nastoliť iba vtedy, ak sú všetky elementárne stupne reakčného mechanizmu v rovnováhe. Nech sú mechanizmy priamych a reverzných reakcií akokoľvek zložité, ale v rovnovážnom stave musia zabezpečiť stechiometrický prechod východiskových látok na produkty reakcie a späť. To znamená, že algebraický súčet všetkých štádií procesu sa rovná stechiometrickej reakčnej rovnici, t.j. stechiometrické koeficienty sú súčtom molekúl všetkých stupňov mechanizmu.
Pre komplexnú reakciu
aA + bB cC + dD
|
K c = |
Pri rovnakej teplote je pomer súčinu rovnovážnych koncentrácií produktov reakcie v mocninách rovných stechiometrickým koeficientom k súčinu rovnovážnych koncentrácií východiskových látok v mocninách rovných stechiometrickým koeficientom konštantná hodnota.
Toto je druhá formulácia zákona o hromadnej akcii.
Výraz pre rovnovážnu konštantu heterogénnej reakcie zahŕňa iba koncentrácie látok v kvapalnej alebo plynnej fáze, pretože koncentrácie tuhých látok zostávajú spravidla konštantné.
Napríklad výraz pre rovnovážnu konštantu nasledujúcej reakcie
CO 2 (g) + C (tv) 2 CO (g)
sa píše takto:
Komu c =  .
.
Rovnováha rovnovážnej konštanty ukazuje, že za rovnovážnych podmienok sú koncentrácie všetkých látok zúčastňujúcich sa reakcie vzájomne prepojené. Číselná hodnota rovnovážnej konštanty určuje, aký by mal byť pomer koncentrácií všetkých reaktantov v rovnováhe.
Zmena koncentrácie ktorejkoľvek z týchto látok má za následok zmenu koncentrácií všetkých ostatných látok. V dôsledku toho sa stanovia nové koncentrácie, ale pomer medzi nimi opäť zodpovedá rovnovážnej konštante.
Hodnota rovnovážnej konštanty závisí od charakter reaktantov a teplota.
Rovnovážna konštanta vyjadrená ako molárne koncentrácie reaktantov ( Komus) a rovnovážna konštanta vyjadrená ako rovnovážne parciálne tlaky ( KomuR) (pozri „Základy chemickej termodynamiky“), sú vzájomne prepojené vzťahmi:
KomuR= KsRT , Kc = KR / (RT) ,
kde je zmena počtu plynných mólov v reakcii.
Štandardná zmena v Gibbsovej energii je
G T = - RT ln Kp,
G T = H – T S.
Po prirovnaní správnych častí rovníc:
- RT ln Kp = H – T S
ln K R = - H / ( RT) + S/ R .
Rovnica nielenže určuje typ závislosti konštanty od teploty, ale tiež ukazuje, že konštanta je určená povahou reagujúcich látok.
Rovnovážna konštanta nezávisí od koncentrácií (ako aj rýchlostnej konštanty reakcie), reakčného mechanizmu, aktivačnej energie a prítomnosti katalyzátorov.. Zmena mechanizmu, napríklad pri zavedení katalyzátora, neovplyvňuje číselnú hodnotu rovnovážnej konštanty, ale samozrejme mení rýchlosť, akou sa rovnovážny stav dosiahne.
Chemická rovnovážna konštanta
Kvantitatívna charakteristika chemickej rovnováhy je rovnovážna konštanta , ktoré možno vyjadriť pomocou rovnovážnych koncentrácií C i, parciálnych tlakov P i alebo molárnych frakcií X i reaktantov. Pre nejakú reakciu
zodpovedajúce rovnovážne konštanty sú vyjadrené takto:



Rovnovážna konštanta je charakteristická veličina pre každú reverzibilnú chemickú reakciu; hodnota rovnovážnej konštanty závisí len od charakteru reagujúcich látok a teploty. Na základe stavovej rovnice ideálneho plynu, zapísanej ako vzťah P i = C i RT, kde С i = n i /V, a Daltonovho zákona pre ideálnu zmes plynov, vyjadrenej rovnicou P = ΣP i, môžeme odvodiť vzťah medzi parciálnym tlakom P i, molárnou koncentráciou C i a molárnym zlomkom X i i-tej zložky:
![]()
Odtiaľ dostaneme vzťah medzi Kc, Kp a Kx:
![]()
Δν je zmena počtu mólov plynných látok počas reakcie:
Δν = – ν 1 – ν 2 – ... + ν" 1 + ν" 2 + ...
Hodnota rovnovážnej konštanty K x, na rozdiel od rovnovážnych konštánt K c a K p, závisí od celkového tlaku Р.
Výraz pre rovnovážnu konštantu elementárnej reverzibilnej reakcie možno odvodiť z kinetických konceptov. Zvážte proces nastolenia rovnováhy v systéme, v ktorom sú v počiatočnom okamihu prítomné iba počiatočné látky. Rýchlosť priamej reakcie V1 je v tomto momente maximálna a rýchlosť spätnej reakcie V2 je nulová:
![]()
![]()
So znižovaním koncentrácie východiskových látok sa zvyšuje koncentrácia reakčných produktov; v súlade s tým sa rýchlosť priamej reakcie znižuje, rýchlosť spätnej reakcie sa zvyšuje. Je zrejmé, že po určitom čase sa rýchlosti priamych a spätných reakcií vyrovnajú, po čom sa koncentrácie reaktantov prestanú meniť, t.j. nastolí sa chemická rovnováha.
Za predpokladu, že V 1 \u003d V 2, môžeme napísať:

Rovnovážna konštanta je teda pomer rýchlostných konštánt priamych a reverzných reakcií. Z toho vyplýva fyzikálny význam rovnovážnej konštanty: ukazuje, koľkokrát je rýchlosť priamej reakcie väčšia ako rýchlosť spätnej pri danej teplote a koncentráciách všetkých reaktantov rovných 1 mol/l. Vyššie uvedené odvodenie výrazu pre rovnovážnu konštantu však vychádza zo všeobecne nesprávneho predpokladu, že rýchlosť chemickej reakcie je priamo úmerná súčinu koncentrácií reaktantov, braných v mocninách rovných stechiometrickým koeficientom. Ako je známe, vo všeobecnom prípade sa exponenty pri koncentráciách činidiel v kinetickej rovnici chemickej reakcie nezhodujú so stechiometrickými koeficientmi.
11. Redoxné reakcie: definícia, základné pojmy, podstata oxidácie a redukcie, najdôležitejšie oxidačné a redukčné činidlá reakcie.
Redox sa nazýva procesy, ktoré sú sprevádzané presunom elektrónov z jedného voľného alebo viazaného atómu na iné. Keďže v takýchto prípadoch nezáleží na stupni posunutia, ale iba na počte vytesnených elektrónov, je zvykom podmienečne považovať vytesnenie vždy za úplné a hovorí sa o spätnom ráze alebo posunutí elektrónov.
Ak atóm alebo ión prvku daruje alebo prijme elektróny, potom v prvom prípade oxidačný stav prvku stúpa a prechádza do oxidovanej formy (OF) a v druhom prípade klesá a prvok prechádza do redukovanej formy (WF). Obe formy tvoria konjugovaný redoxný pár. Každá redoxná reakcia zahŕňa dva konjugované páry. Jedna z nich zodpovedá prechodu oxidačného činidla, ktoré prijíma elektróny do svojej redukovanej formy (OF 1 → VF 1), a druhá zodpovedá prechodu redukčného činidla, ktoré odovzdáva elektróny do svojej oxidovanej formy (VF 2 → OF 2 ), napríklad:
Cl2 + 2 I - → 2 Cl - + I 2
Z 1 WF 1 WF 2 Z 2
(tu Cl 2 je oxidačné činidlo, I je redukčné činidlo)
Rovnaká reakcia je teda vždy procesom oxidácie redukčného činidla aj procesom redukcie oxidačného činidla.
Koeficienty v rovniciach redoxných reakcií možno nájsť metódy elektronickej váhy a elektrón-iónová rovnováha. V prvom prípade je počet prijatých alebo darovaných elektrónov určený rozdielom oxidačných stavov prvkov v počiatočnom a konečnom stave. Príklad:
HN 5+ O 3 + H 2 S 2– → N 2+ O + S + H 2 O
Pri tejto reakcii sa oxidačný stav mení dvoma prvkami: dusíkom a sírou. Elektronické vyrovnávacie rovnice:
Podiel disociovaných molekúl H 2 S je nevýznamný, preto sa do rovnice dosadí nie ión S 2–, ale molekula H 2 S. Najprv sa vyrovná bilancia častíc. Zároveň sa v kyslom prostredí na vyrovnanie využívajú vodíkové ióny pridané do oxidovanej formy a molekuly vody pridané do redukovanej formy. Potom sa rovnováha nábojov vyrovná a koeficienty vyrovnávajúce počet daných a prijatých elektrónov sú vyznačené napravo od čiary. Potom je súhrnná rovnica napísaná nižšie, berúc do úvahy koeficienty:
Získali sme redukovanú iónovo-molekulárnu rovnicu. Pridaním iónov Na + a K + získame podobnú rovnicu v plnej forme, ako aj molekulárnu rovnicu:
NaNO 2 + 2 KMnO 4 + 2 KOH → NaNO 3 + 2 K 2 MnO 4 + H 2 O
V neutrálnom médiu sa rovnováha častíc vyrovná pridaním molekúl vody na ľavú stranu polovičných reakcií a ióny H + alebo OH - sa pridajú na pravú stranu:
I2 + Cl2 + H20 → HIO3 + HCl
Východiskové materiály nie sú kyseliny ani zásady, preto je v počiatočnom období reakcie médium v roztoku takmer neutrálne. Rovnice polovičnej reakcie:
| I 2 + 6 H 2 O + 10e → 2 IO 3 – + 12 H + | |
| Cl 2 + 2e → 2 Cl - | |
| I2 + 5 Cl2 + 6 H20 → 2 IO3 - + 12 H + + 10 Cl - |
Reakčná rovnica v molekulárnej forme:
I2 + 5 Cl2 + 6 H20 -> 2 HIO3 + 10 HCl.
NAJDÔLEŽITEJŠIE OXIDÁTORY A REDUKTORY. KLASIFIKÁCIA REDOXNÝCH REAKCIÍ
Hranice oxidácie a redukcie prvku sú vyjadrené maximálnymi a minimálnymi hodnotami oxidačných stavov *. V týchto extrémnych stavoch, určených pozíciou v periodickej tabuľke, má prvok schopnosť vykazovať iba jednu funkciu - oxidačné alebo redukčné činidlo. V súlade s tým sú látky obsahujúce prvky v týchto oxidačných stupňoch iba oxidačnými činidlami (HNO 3, H 2 SO 4, HClO 4, KMnO 4, K 2 Cr 2 O 7 atď.) alebo iba redukčnými činidlami (NH 3, H 2 S, halogenovodíky, Na2S203 atď.). Látky obsahujúce prvky v stredných oxidačných stavoch môžu byť oxidačnými aj redukčnými činidlami (HClO, H 2 O 2, H 2 SO 3 atď.).
Redoxné reakcie sú rozdelené do troch hlavných typov: intermolekulárne, intramolekulárne a disproporcionačné reakcie.
Prvý typ zahŕňa procesy, v ktorých sú atómy oxidačného prvku a redukčného prvku súčasťou rôznych molekúl.
Intramolekulárne reakcie sa nazývajú reakcie, pri ktorých sú oxidačné činidlo a redukčné činidlo vo forme atómov rôznych prvkov súčasťou tej istej molekuly. Napríklad tepelný rozklad chlorečnanu draselného podľa rovnice:
2 KClO 3 -> 2 KCl + 3 O 2
Disproporcionačné reakcie sú procesy, pri ktorých je oxidačné činidlo a redukčné činidlo ten istý prvok v rovnakom oxidačnom stave, ktorý sa v reakcii znižuje aj zvyšuje, napríklad:
3 HClO → HClO 3 + 2 HCl
Možné sú aj reverzné disproporcionačné reakcie. Patria sem intramolekulárne procesy, pri ktorých je oxidačným a redukčným činidlom ten istý prvok, ale vo forme atómov, ktoré sú v rôznych stupňoch oxidácie a v dôsledku reakcie ju vyrovnávajú napr.
Nové články
- Blahoželáme k Valentínovi vášmu milovanému manželovi, priateľovi, priateľke, priateľom vo veršoch a próze
- Blesk na iPhone nefunguje Prečo na iPhone 6 nefunguje baterka
- Spôsoby, ako uložiť kontakty z iPhone
- Prvoaprílové žarty pre priateľov: Zaujímavé nápady
- Jennifer Aniston a Justin Theroux: Príbeh lásky, ktorý by sa jej nemuseli páčiť
- Účtovné zápisy pre lízingové operácie
- Softvér: vlastnosti a recenzie
- Kúrenie a spotreba energie
- Gratulujem dcére od rodičov v próze
- Recenzia základnej dosky ASUS M5A97 R2
Populárne články
- Huawei nova Lite – Špecifikácie
- Prehľad programov na pretaktovanie procesorov
- Recenzia notebooku Lenovo Yoga Book: Takmer sen umelca
- Recenzia Samsung Galaxy A7 (2017) – vychádza z úspechu porovnania fotoaparátu Samsung galaxy a7
- Aplikované vedy: čo to je a aký je ich význam?
- Deviantné správanie: typy, príčiny a prejavy Pozitívne a negatívne odchýlky
- Anisimov I.: Zola a naša doba
- Mýtus o Zeusovi - bohu neba, hromu a blesku Cyclopes a Hecatoncheires
- Viera, ktorá stratila vieru Bojím sa, že stratím vieru, čo mám robiť
- Nová interpretácia dobra a zla v príbehu L


