Izračun konstante ravnotežja sistema. kemično ravnovesje. konstanta kemijskega ravnovesja
Naloga 135.
Izračunajte konstanto ravnotežja za homogeni sistem
če je ravnotežna koncentracija reaktantov (mol/l):
[CO] P = 0,004; [H2O] P = 0,064; [CO 2 ] P = 0,016; [H 2] p \u003d 0,016,
Kakšne so začetne koncentracije vode in CO? Odgovor: K = 1; ref = 0,08 mol/l; [CO]ref =0,02 mol/l.
rešitev:
Enačba reakcije je:
CO (g) + H 2 O (g) CO 2 (g) + H2 (g)
Konstanta enačbe za to reakcijo ima izraz:
Za iskanje začetnih koncentracij snovi H 2 O in CO upoštevamo, da po reakcijski enačbi iz 1 mol CO in 1 mol H 2 O nastane 1 mol CO 2 in 1 mol H 2 oblikovana. Ker je glede na pogoj problema v vsakem litru sistema nastalo 0,016 mol CO 2 in 0,016 mol H 2, je bilo porabljenih 0,016 mol CO in H 2 O. Tako so želene začetne koncentracije:
Ref \u003d [H 2 O] P + 0,016 \u003d 0,004 + 0,016 \u003d 0,02 mol / l;
[CO] ref \u003d [CO] P + 0,016 \u003d 0,064 + 0,016 \u003d 0,08 mol / l.
odgovor: Kp = 1; ref = 0,08 mol/l; [CO] ref = 0,02 mol/l.
Naloga 136.
Ravnotežna konstanta homogenega sistema
pri določeni temperaturi je enaka 1. Izračunajte ravnotežne koncentracije vseh reagirajočih snovi, če so začetne koncentracije enake (mol/l): [CO] ref = 0,10; [H 2 O] ref = 0,40.
Odgovor: [CO 2] P \u003d [H 2] P \u003d 0,08; [CO]P = 0,02; [H2O] P = 0,32.
rešitev:
Enačba reakcije je:
CO (g) + H 2 O (g) CO 2 (g) + H 2 (g)
V ravnovesju sta hitrosti neposredne in povratne reakcije enaki, razmerje med konstantami teh hitrosti pa je konstantno in se imenuje ravnotežna konstanta danega sistema:

Z x mol / l označimo ravnotežno koncentracijo enega od reakcijskih produktov, potem bo ravnotežna koncentracija drugega tudi x mol / l, saj oba nastaneta v enaki količini. Ravnotežne koncentracije izhodnih snovi bodo:
[CO] ref = 0,10 – x mol/l; [H 2 O] ref = 0,40 - x mol / l. (ker nastajanje x mol / l reakcijskega produkta porabi x mol / l CO in H 2 O. V trenutku ravnotežja bo koncentracija vseh snovi (mol / l): [CO 2 ] P \u003d [H 2] P = x; [CO] P = 0,10 - x; [H 2 O] P = 0,4 - x.
Te vrednosti nadomestimo v izraz za konstanto ravnotežja:
![]()
Če rešimo enačbo, dobimo x = 0,08. Zato koncentracijsko ravnovesje (mol/l):
[CO 2 ] P = [H 2 ] P = x = 0,08 mol/l;
[H 2 O] P \u003d 0,4 - x \u003d 0,4 - 0,08 \u003d 0,32 mol / l;
[CO] P \u003d 0,10 - x \u003d 0,10 - 0,08 \u003d 0,02 mol / l.
Naloga 137.
Konstanta ravnotežja homogenega sistema N 2 + 3H 2 \u003d 2NH 3 pri določeni temperaturi je 0,1. Ravnotežni koncentraciji vodika in amoniaka sta 0,2 oziroma 0,08 mol/l. Izračunajte ravnotežno in začetno koncentracijo dušika. Odgovor: P = 8 molov/l; ref = 8,04 mol/l.
rešitev:
Enačba reakcije je:
N 2 + ZN 2 \u003d 2NH 3
Označimo ravnotežno koncentracijo N2 kot x mol/L. Izraz za konstanto ravnovesja te reakcije je:

Nadomestimo podatke problema v izraz konstante ravnotežja in poiščemo koncentracijo N 2

Za iskanje začetne koncentracije N 2 upoštevamo, da se po reakcijski enačbi za nastanek 1 mola NH 3 porabi ½ mola N 2. Ker je po pogoju problema v vsakem litru sistema nastalo 0,08 mol NH 3, je 0,08 . 1/2 \u003d 0,04 mol N 2. Tako je želena začetna koncentracija N 2 enaka:
Ref \u003d P + 0,04 \u003d 8 + 0,04 \u003d 8,04 mol / l.
odgovor: P = 8 molov/l; ref = 8,04 mol/l.
Naloga 138
Pri neki temperaturi ravnovesje homogenega sistema
2NO + O 2 ↔ 2NO 2 smo ugotovili pri naslednjih koncentracijah reaktantov (mol/l): p = 0,2; [O 2 ] p = 0,1; p = 0,1. Izračunajte konstanto ravnotežja in začetno koncentracijo NO in O 2 . Odgovor: K = 2,5; ref = 0,3 mol/l; [O 2 ] ex x = 0,15 mol/l.
rešitev:
Enačba reakcije:
2NO + O 2 ↔ 2NO 2

Za iskanje začetnih koncentracij NO in O 2 upoštevamo, da po reakcijski enačbi iz 2 mol NO in 1 mol O2 nastane 2 mol NO 2, nato pa se porabi 0,1 mol NO in 0,05 mol O 2. Tako sta začetni koncentraciji NO in O 2 enaki:
Ref = NO] p + 0,1 = 0,2 + 0,1 = 0,3 mol/l;
[O 2] ref \u003d [O 2] p + 0,05 \u003d 0,1 + 0,05 \u003d 0,15 mol / l.
odgovor: Kp = 2,5; ref = 0,3 mol/l; [O 2] ref = 0,15 mol / l.
Naloga 139.
Zakaj se ravnotežje sistema premakne, ko se tlak spremeni?
N 2 + 3Н 2 ↔ 2NH 3 in se ravnotežje sistema N 2 + O 2 2NO ne premakne? Svoj odgovor utemeljite z izračunom hitrosti prednjih in povratnih reakcij v teh sistemih pred in po spremembi tlaka. Zapišite izraze za ravnotežne konstante vsakega od teh sistemov.
rešitev:
a) enačba reakcije:
N 2 + 3H 2 ↔ 2NH 3.
Iz reakcijske enačbe izhaja, da reakcija poteka z zmanjševanjem volumna v sistemu (iz 4 molov plinastih snovi nastaneta 2 mola plinastih snovi). Zato bo s spremembo tlaka v sistemu opaziti premik ravnovesja. Če se tlak v tem sistemu poveča, potem se bo po Le Chatelierjevem principu ravnovesje premaknilo v desno proti zmanjšanju prostornine. Ko se ravnovesje v sistemu premakne v desno, bo hitrost neposredne reakcije večja od hitrosti povratne reakcije:
pr>arr ali pr \u003d k 3\u003e o br \u003d k 2.
Če se tlak v sistemu zmanjša, se bo ravnotežje sistema premaknilo v levo, v smeri povečanja prostornine, potem ko se bo ravnotežje premaknilo v levo, bo hitrost neposredne reakcije manjša od hitrosti direktni:
itd< обр или (пр = k 3 )< (обр = k 2).
b) Reakcijska enačba:
N2 + O2) ↔ 2NO. .
Iz reakcijske enačbe sledi, da če reakcije ne spremlja sprememba prostornine, reakcija poteka brez spremembe števila molov plinastih snovi. Zato sprememba tlaka v sistemu ne bo povzročila premika ravnotežja, zato bosta hitrosti reakcije naprej in nazaj enaki:
pr \u003d arr \u003d ali (pr k [O 2]) \u003d (arr \u003d k 2) .
Naloga 140.
Začetni koncentraciji ref in [С1 2 ]ref v homogenem sistemu
2NO + Cl 2 ↔ 2NOС1 sta 0,5 oziroma 0,2 mol/l. Izračunajte konstanto ravnotežja, če je do trenutka, ko je doseženo ravnotežje, reagiralo 20 % NO. Odgovor: 0,417.
rešitev:
Reakcijska enačba je: 2NO + Cl 2 ↔ 2NOС1
Glede na pogoj problema je v reakcijo vstopilo 20 % NO, kar je 0,5 .
0,2 = 0,1 mol, vendar 0,5 - 0,1 = 0,4 mol NO ni reagiral. Iz reakcijske enačbe sledi, da se za vsaka 2 mola NO porabi 1 mol Cl2 in nastaneta 2 mola NOCl. Zato je 0,05 mol Cl 2 reagiral z 0,1 mol NO in nastalo je 0,1 mol NOCl. 0,15 mol Cl 2 je ostalo neporabljenih (0,2 - 0,05 = 0,15). Tako so ravnotežne koncentracije vpletenih snovi enake (mol / l):
P = 0,4; p=0,15; p = 0,1.
Ravnotežna konstanta te reakcije je izražena z enačbo:
![]()
Če v tem izrazu nadomestimo ravnotežne koncentracije snovi, dobimo.
KEMIJSKO RAVNOTEŽJE. KONSTANTA KEMIJSKEGA RAVNOTEŽJA
Primer 1. Izračunajte spremembo Gibbsove energije ΔG pri reakciji dimerizacije dušikovega dioksida 2NO 2 (g) = N 2 O 4 (g) pri standardni temperaturi 298 K, 273 K in 373 K. Sklepajte o smeri postopek. Določite konstante ravnotežja reakcije dimerizacije dušikovega dioksida pri zgoraj navedenih temperaturah. Določite temperaturo, pri kateri je Δ G = 0. Naredite sklep o smeri te reakcije nad in pod to temperaturo. Termodinamične lastnosti komponent:
ΔΗ° 298 S o 298
V-v kJ/mol J/mol*K
NO 2 (g) 33,3 240,2
N2O4 (g) 9,6 303,8
rešitev. Za reverzibilen postopek:
aA (d) + bB (d) ⇄ cc (d) + dD (d)
izraz za konstanto ravnotežja K p bo
K p \u003d (P c C * P d D) / (P a A * P b B)
kjer PA, P B, P C, P D - ravnotežni parcialni tlaki plina komponente A, B, C, D a, b, c, d - stehiometrični koeficienti.
Za postopek aA (g) +bB (in) ⇄ z C(g) +dD (g) izraz za konstanto ravnotežja
K c = (C c C *C d D)/(C a A *C b B)
kjer C A , C B , C C , C D - ravnotežne koncentracije snovi A, B, C, D a, b, c, d - stehiometrični koeficienti.
Po formuli (1.4.1) imamo za sistem 2NO 2 ⇄ N 2 O 4
K p \u003d P N 2 O 4 / P 2 NO 2
Pri standardni temperaturi 298 K je sprememba entalpije (ΔH o reakcije) določena s formulo (1.2.2)
ΔH o reakcija \u003d ΔΗ ° 298 N 2 O 4 - 2ΔΗ ° 298 NO 2 \u003d 9,6-2 * 33,5 \u003d -57400 J.
Sprememba entropije (1.3.5)
ΔS o reakcija \u003d S ° 298 N2O4 - 2S ° 298 NO2 \u003d 303,8-2 * (240,2) \u003d -176 J / mol * K
Z uporabo Le Chatelierjevega principa, ki pravi, da ko se spremenijo pogoji, pod katerimi je reverzibilna reakcija v ravnotežju, se bo ravnotežje premaknilo v smeri spremembe procesa oslabitve, napovemo smer premika ravnotežja. Vrednost ΔΗ o je negativna, zato je reakcija nastajanja eksotermna (poteka s sproščanjem toplote) in z znižanjem temperature bi se moralo ravnotežje premakniti v desno, s povišanjem temperature - v levo. Poleg tega v skladu s formulo (1.3.6), če vemo, da je ΔH
ΔPojdi 273; ΔPojdi 298; ΔG o 373 in K 273; K298; K 373
Vrednost Gibbsove energije za dane temperature se izračuna po formuli (1.3.7):
ΔG o 298 \u003d ΔH o -TΔS o \u003d -57400-298 * (-176) \u003d -4952 J.,
ΔG o 273 \u003d -57400-273 * (-176) \u003d -9352J:
ΔG o 373 \u003d -57400-373 * (-176) \u003d 7129 J.
Negativna vrednost ΔG o 298 označuje premik reakcijskega ravnovesja v desno, višja negativna vrednost ΔG o 273 pa kaže, da se ravnotežje premakne v desno, ko se temperatura zniža z (298 na 273 K).
Pozitivna vrednostΔG o 373 označuje spremembo smeri spontanega procesa. Pri tej temperaturi postane boljša obratna reakcija (premik ravnotežja v levo).
Ravnotežne konstante K p in Gibbsova energija ΔG o sta povezani s formulo
kjer je K p konstanta ravnotežja procesa; R plinska konstanta; T je absolutna temperatura. Po formuli (1.4.3) imamo:
lnK 273 \u003d - ΔG o 273 /RT \u003d 9352 / 8,31 * 273 \u003d 4,12
lnK 298 \u003d -ΔG o 298 / RT \u003d 4952 / 8,31 * 298 \u003d 2
lnK 373 \u003d -ΔG o 373 / RT \u003d -7129 / 8,31 * 298 \u003d -2,3
vrednost K 298 in K 273 > 1 kaže na premik ravnotežja v desno (primerjaj z (1.4.1)) in čim več, tem višja je vrednost konstante ravnotežja. K 373< 1, говорит ο смещении равновесия в системе влево (сравни с (1.4.1)).
Pogoj ΔG o reakcija =0 ustreza ravnotežni konstanti,
enako ena.
Izračunajte temperaturo T, ki ustreza tej konstanti, po formuli (1.3.7):
ΔG°=ΔΗ°-TΔS o ; O=ΔH o -TΔS o;
T Δ G =0 =ΔΗ°/ΔS°=57400/176=326,19 K
Zaključek. Pri temperaturi 326,19 K potekata prednja in povratna reakcija z enako verjetnostjo, K p =1. Ko se temperatura znižuje, se ravnovesje premakne v desno in levo, ko temperatura narašča.
Primer 2. Ravnotežna konstanta K p reakcije sinteze NH 3 z reakcijo N 2+3 H2 \u003d\u003d 2NH 3 pri 623 K je 2,32 * 10 -13. Izračunajte Kc pri isti temperaturi.
rešitev. Komunikacija K p in K z poteka po formuli
K p = K c (RT) Δ n, (1.4.4)
Δn= n 2 - n 1 \u003d 2-4 \u003d -2, kjer sta n 1 in n 2 število molov reagentov in produktov. Posledično
K c \u003d K p / (RT) Δ n \u003d 0,624 * 10 -5
Odgovori. K \u003d 0,624 * 10 -5.
Primer 2 Disociacijska elastičnost kalcijevega karbonata pri 1154 K je 80380 Pa, pri 1164 K pa 91177 Pa. Izračunajte, pri kateri temperaturi bo elastičnost disociacije kalcijevega karbonata enaka 101325 Pa.
rešitev. Reakcija disociacije CaCO 3 (cr) ⇄ CaO (cr) + CO 2 (g)
Zato po (1.4.1)
K p \u003d P CO 2
Zato bodo pri vsaki temperaturi (T 1 - 1154 K; Τ \u003d 1164 K * Τ \u003d X) ravnotežne konstante ustrezale tlaku:
K T 1 = 80380; K T 2 = 91177; K T 3 = 101325.
Odvisnost konstante ravnotežja od temperature prikazuje Arrheniusova enačba
dlnK p /dT= ΔΗ/RT 2 (1.4.5)
kjer je K p konstanta ravnotežja; Τ - temperatura, K; ΔΗ je toplotni učinek reakcije; R je plinska konstanta.
Z integracijo enačbe (1.4.5) v temperaturnem območju T 1 -T 2 pri Δ H= const dobimo
lnK T 1 /K T 2 \u003d ΔΗ / R (1 / T 1 -1 / T 2),
Kjer sta K T 1 in K T 2 konstanti ravnotežja pri T 1 in T 2.
Najprej določimo ΔH (v skladu s 1.4.6)
ΔΗ=ln(91177*8,31*1154*1164/80380*10)=140500 J/mol.
ln(101325/91177)=140500/8,31(1/1164-1/T 3)
T 3 \u003d 1172 K
Odgovori. Pri T=1172K bo elastičnost disociacije kalcijevega karbonata enaka 101325 Pa.
Naloge
56. Disociacijska konstanta ocetna kislina pri 298 K je enako 1,75 * 10 -5. Kakšna je sprememba Gibbsove energije disociacije ocetne kisline?
57. Poiščite vrednost Gibbsove energije (ΔG o 298) in ravnotežno konstanto K 298 za reakcijo BaSO 4 (cr) → Ba 2+ (p) + SO 2- 4 (p).
Za izračun uporabite naslednje podatke:
Snov S o 298 J / mol * K ΔH o 298 kJ / mol 2 ^ 2 ^
BaSO4 (cr) 132,4 -1447,39
Ba 2+ (p) 9,64 -533,83
SO 2-4 (p) 18.44 -904.2.
58. Poiščite konstanto ravnotežja pri 473 K za reakcijo hidratacije etilena
C 2 H 4 (g) + H 2 O (g) \u003d C 2 H 5 OH (g).
Upoštevajte lastnosti reagentov v tabeli. 3. Zanemarjamo odvisnost ΔS in ΔH od temperature.
59. Ob predpostavki, da ∆Ho 298 in ∆S približno 298 reakcije 4HCl + O 2 ⇄ 2H 2 O + 2Cl 2 niso odvisne od temperature, poiščite temperaturo, pri kateri
K p \u003d 1 in ΔG o = O.
60. S tabelarnimi podatki izračunajte ravnotežne konstante naslednjih reakcij pri 298 K in 1000 K:
a) H 2 O (g) + CO ⇄ CO 2 + H 2
b) CO 2 + C (gr) ⇄ 2SO;
c) N 2 + 3H 2 ⇄ 2NH 3.
Zanemarjamo spremembe ΔH o in S o zaradi temperature.
61. Za neko spontano reakcijo Δ S< О. Как будет изменяться константа равновесия с повышением температуры: а) увеличиваться, б) уменьшаться, в) по данным задачи нельзя определить.
62. Brez uporabe izračunov nastavite znak ΔS o naslednjih procesov:
a) 2NH 3 (g) ⇄ N 2 (g) + H 2 (g);
b) CO 2 (cr) ⇄ CO 2 (g);
c) 2NO (g) + O 2 (g) = 2NO 2 (g);
d) 2H 2 S (g) + 3O 2 \u003d 2H 2 O (g) + 2SO 2 (g);
e) 2CH 3 OH (g) + 3O 2 (g) \u003d 4H 2 O (g) + 2CO 2 (g).
63. V kateri od naslednjih primerih reakcija je možna pri katerikoli temperaturi: a) ΔH°< 0, ΔS°>0; b) Δ H°<0, ΔS°<0; в) Δ Н°>0, ∆S°> 0 ?
64. V katerem od naslednjih primerov je reakcija nemogoča pri kateri koli temperaturi: a) ΔН°> 0, ΔS°> 0; b) Δ Н°>0, ΔS°<0; в) Δ Н°<0, ΔS°<0 ?
65. Če je ΔΗ°<0 и ΔS°<0 ,
V katerem od naslednjih primerov lahko reakcija poteka spontano?
a)| ΔH°| > |TΔS°|; b)| ΔH°| > |TΔS°| ?
66. Kateri učinki na sistem lahko spremenijo ravnotežje sistemov:
a) N 2 (g) + 3H 2 (g) ⇄ 2NH 3 (g);
b) 4Fe (cr) + 3O 2 (g) ⇄ 2Fe 2 O 3 (cr);
c) SO 2 (g) + O 2 (g) ⇄ 2SO 3 (g).
67. V katero smer se bo ravnotežje premaknilo s povišanjem temperature v sistemih:
1) COCl 2 ⇄ CO + Cl 2; ΔН°=113 kJ;
2) 2SO ⇄ CO 2 + C; ΔН°=-171 kJ;
3) 2SO 3 ⇄ 2SO 2 + O 2; ΔН°=192 kJ.
68. V katero smer se bo ravnotežje premaknilo z naraščajočim tlakom v sistemih:
1) H 2 (g) + S (cr) ⇄ H 2 S (g);
2) 2CO (g) ⇄ CO 2 (g) + C (g);
3) 4HCl (g) + O 2 (g) ⇄ 2H 2 O (g) + 2Cl 2 (g).
69. Kako bo vplivalo na ravnotežje naslednjih reakcij:
CaCO 3 (cr) ⇄ CaO (cr) + CO 2 (g); ΔН°=178 kJ;
2CO (g) + O 2 (g) ⇄ 2CO 2; ΔН°=-566 kJ;
N 2 (g) + O 2 (g) ⇄ 2NO (g); ΔН°=180 kJ.
a) zvišanje temperature
b) povečanje tlaka?
70. Z referenčnimi podatki poiščite približno vrednost temperature, pri kateri je konstanta ravnotežja reakcije nastajanja vodnega plina
C (g) + H 2 O (g) ⇄ CO (g) + H 2 (g)
enaka 1. Zanemarjamo odvisnost ΔH o in S o od temperature.
71. Ravnotežna konstanta K p reakcije CO + Cl 2 ⇄ COCl 2 pri 600 o C je 1,67 * 10 -6. Izračunajte K iz reakcije pri dani temperaturi.
72. Elastičnost disociacije magnezijevega karbonata pri 1000 K je 42189 Pa, pri 1020 K - 80313 Pa. Določite toplotni učinek reakcije MgCO 3 ⇄ MgO + CO 2 in temperaturo, pri kateri postane elastičnost disociacije magnezijevega karbonata enaka 1 Pa.
Kemijsko ravnovesje je stanje reverzibilne kemijske reakcije
aA + b B= c C+ d D,
pri kateri sčasoma ni sprememb v koncentracijah reaktantov v reakcijski mešanici. Označeno je stanje kemijskega ravnovesja konstanta kemijskega ravnovesja:
kje C i so koncentracije komponent v ravnovesje popolna mešanica.
Ravnotežno konstanto lahko izrazimo tudi z ravnotežnimi molskimi deleži X i komponente:
Za reakcije, ki potekajo v plinski fazi, je priročno izraziti ravnotežno konstanto v smislu ravnotežnih parcialnih tlakov Pi komponente:
Za idealne pline Pi = C i RT in Pi = X i P, kje p je skupni pritisk, torej KP, K C in K X so povezani z naslednjim razmerjem:
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
Ravnotežna konstanta je povezana z r G o kemična reakcija:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
spremeniti r G oz r F v kemijski reakciji pri danih (ne nujno ravnotežnih) parcialnih tlakih Pi ali koncentracije C i komponente je mogoče izračunati z enačbo izoterme kemijske reakcije (van't Hoffove izoterme):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Po navedbah Le Chatelierjevo načeloČe na sistem v ravnotežju deluje zunanji vpliv, se bo ravnovesje premaknilo tako, da se učinek zunanjega vpliva zmanjša. Tako povečanje tlaka premakne ravnotežje v smeri zmanjšanja števila molekul plina. Dodatek reakcijske komponente ravnotežni zmesi premakne ravnotežje v smeri zmanjševanja količine te komponente. Zvišanje (ali znižanje) temperature premakne ravnovesje v smeri reakcije, ki poteka z absorpcijo (sproščanjem) toplote.
Kvantitativno je odvisnost konstante ravnotežja od temperature opisana z enačbo izobare kemijske reakcije (van't Hoffove izobare)
![]() (9.9)
(9.9)
in izohore kemijske reakcije (van't Hoffove izohore)
![]() . (9.10)
. (9.10)
Integracija enačbe (9.9) ob predpostavki, da r H reakcija ni odvisna od temperature (kar velja v ozkih temperaturnih območjih), daje:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
kje C- integracijska konstanta. Tako je odvisnost ln K P od 1 /T mora biti linearen, naklon ravne črte pa je - r H/R.
Integracija znotraj K 1 , K 2 in T 1, T 2 daje:
 (9.13)
(9.13)
 (9.14)
(9.14)
Z uporabo te enačbe lahko izračunamo, če poznamo konstante ravnotežja pri dveh različnih temperaturah r H reakcije. Skladno s tem vedenje r H reakcijo in konstanto ravnotežja pri eni temperaturi, lahko izračunate konstanto ravnotežja pri drugi temperaturi.
PRIMERI
CO (g) + 2H 2 (g) \u003d CH 3 OH (g)
pri 500K. f G o za CO(g) in CH 3 OH(g) pri 500 K so –155,41 kJ. mol –1 in –134,20 kJ. mol –1 oz.
rešitev. pojdi reakcije:
r G o= f G o(CH3OH) - f G o(CO) = –134,20 – (–155,41) = 21,21 kJ. mol -1.
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Primer 9-2. Konstanta ravnotežja reakcije
je enako K P = 1,64 10 –4 pri 400 o C. Kolikšen skupni tlak je treba uporabiti za ekvimolarno zmes N 2 in H 2, da se 10 % N 2 pretvori v NH 3? Predpostavlja se, da so plini idealni.
rešitev. Pustimo, da mol N 2 reagira. Potem
| N 2 (d) | + | 3H 2 (g) | = | 2NH 3 (g) | |
| Začetna količina | 1 | 1 | |||
| Ravnotežna količina | 1– | 1–3 | 2 (Skupaj: 2–2) | ||
| Ravnotežni molski delež: |
Posledično K X= 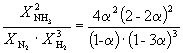 in K P = K X . p –2
=
in K P = K X . p –2
=  .
.
Če zamenjamo = 0,1 v nastalo formulo, imamo
1.64 10 –4 = , kje p= 51,2 atm.
, kje p= 51,2 atm.
Primer 9-3. Konstanta ravnotežja reakcije
CO (g) + 2H 2 (g) \u003d CH 3 OH (g)
pri 500 K je K P = 6,0910–3. Reakcijsko mešanico, ki jo sestavljajo 1 mol CO, 2 mol H 2 in 1 mol inertnega plina (N 2), segrejemo na 500 K in skupni tlak 100 atm. Izračunajte sestavo ravnotežne zmesi.
rešitev. Pustimo, da reagira mol CO. Potem
| Zobnik) | + | 2H 2 (g) | = | CH 3 OH (g) | |
| Začetni znesek: | 1 | 2 | 0 | ||
| Ravnotežna količina: | 1– | 2–2 | |||
| Skupaj v ravnotežni mešanici: | 3–2 mol komponent + 1 mol N 2 \u003d 4–2 mol | ||||
| Ravnotežni molski delež | |||||
Posledično K X=  in K P = K X . P-2 =
in K P = K X . P-2 = ![]() .
.
Tako je 6,09 10 –3 = ![]() .
.
Če rešimo to enačbo, dobimo = 0,732. V skladu s tem so molski deleži snovi v ravnotežni zmesi: = 0,288, = 0,106, = 0,212 in = 0,394.
Primer 9-4. Za reakcijo
N 2 (g) + 3H 2 (g) \u003d 2NH 3 (g)
pri 298 K K P = 6,0 10 5 in f H o(NH 3) \u003d -46,1 kJ. mol -1. Ocenite vrednost konstante ravnovesja pri 500 K.
rešitev. Standardna molska reakcijska entalpija je
r H o= 2f H o(NH 3) \u003d -92,2 kJ. mol -1.
V skladu z enačbo (9.14)  =
=
Ln (6,0 10 5) + ![]() = –1,73, od koder je K 2 =
0.18.
= –1,73, od koder je K 2 =
0.18.
Upoštevajte, da konstanta ravnotežja eksotermne reakcije pada z naraščajočo temperaturo, kar ustreza Le Chatelierjevemu načelu.
NALOGE
- Pri 1273 K in skupnem tlaku 30 atm v ravnotežni mešanici
- Pri 2000 o C in skupnem tlaku 1 atm se 2 % vode disociira na vodik in kisik. Izračunajte konstanto ravnotežja reakcije
- Konstanta ravnotežja reakcije
- Konstanta ravnotežja reakcije
- 3-L posodo, ki je vsebovala 1,7910–2 mol I 2, smo segreli na 973 K. Izkazalo se je, da je tlak v posodi v ravnotežju 0,49 atm. Ob predpostavki, da gre za idealne pline, izračunajte konstanto ravnotežja pri 973 K za reakcijo
- Za reakcijo
- Za reakcijo
- 1-litrsko posodo, ki je vsebovala 0,341 mol PCl 5 in 0,233 mol N 2, smo segreli na 250 o C. Celotni tlak v posodi pri ravnotežju je bil 29,33 atm. Glede na to, da so vsi plini idealni, izračunajte konstanto ravnotežja pri 250 o C za reakcijo, ki poteka v posodi.
- Konstanta ravnotežja reakcije
- Pri 25°C f G o(NH 3) = –16,5 kJ. mol -1. Izračunaj r G reakcije tvorbe NH 3 pri parcialnih tlakih N 2, H 2 in NH 3 enakih 3 atm, 1 atm oziroma 4 atm. V katero smer bo spontano potekala reakcija v teh pogojih?
- eksotermna reakcija
- Ravnotežna konstanta plinskofazne reakcije izomerizacije borneola (C10H17OH) v izoborneol je 0,106 pri 503 K. Zmes 7,5 g borneola in 14,0 g izoborneola smo dali v 5-litrsko posodo in hranili pri 503 K do ravnovesja je bil dosežen. Izračunajte molske deleže in mase borneola in izoborneola v ravnotežni zmesi.
- Ravnovesje v reakciji
- Izračunajte skupni tlak, ki ga je treba uporabiti za zmes 3 delov H 2 in 1 dela N 2, da dobimo ravnotežno zmes, ki vsebuje 10 % prostornine NH 3 pri 400 o C. Konstanta ravnotežja za reakcijo
- Pri 250 o C in skupnem tlaku 1 atm se PCl 5 po reakciji disociira za 80 %.
- Pri 2000 o C za reakcijo
- Izračunajte standardno entalpijo reakcije, za katero je konstanta ravnotežja
a) se poveča za 2-krat, b) zmanjša za 2-krat, ko se temperatura spremeni iz 298 K na 308 K. - Odvisnost konstante ravnotežja reakcije 2C 3 H 6 (g) \u003d C 2 H 4 (g) + C 4 H 8 (g) od temperature med 300 K in 600 K opisuje enačba
CO 2 (g) + C (tv) \u003d 2CO (g)
vsebuje 17 % (volumensko) CO 2 . Kolikšen odstotek CO 2 bo vseboval plin pri skupnem tlaku 20 atm? Pri kakšnem tlaku bo plin vseboval 25 % CO 2 ?
H 2 O (g) \u003d H 2 (g) + 1 / 2O 2 (g) pod temi pogoji.
CO (g) + H 2 O (g) \u003d CO 2 (g) + H 2 (g)
pri 500 o C je Kp= 5,5. Zmes 1 mol CO in 5 mol H 2 O smo segreli na to temperaturo. Izračunajte molski delež H 2 O v ravnotežni mešanici.
N 2 O 4 (g) \u003d 2NO 2 (g)
pri 25 o C je Kp= 0,143. Izračunajte tlak, ki se bo vzpostavil v 1 litrski posodi, v kateri je pri tej temperaturi 1 g N 2 O 4.
I 2 (g) = 2I (g).
pri 250°C r G o \u003d -2508 J. mol -1. Pri katerem skupnem tlaku bo stopnja pretvorbe PCl 5 v PCl 3 in Cl 2 pri 250 o C 30 %?
2HI (g) \u003d H 2 (g) + I 2 (g)
konstanta ravnovesja K P = 1,83 10 –2 pri 698,6 K. Koliko gramov HI nastane, ko 10 g I 2 in 0,2 g H 2 segrejemo na to temperaturo v trilitrski posodi? Kakšni so parcialni tlaki H 2 , I 2 in HI?
PCl 5 (g) = PCl 3 (g) + Cl 2 (g)
CO (g) + 2H 2 (g) \u003d CH 3 OH (g)
pri 500 K je K P = 6,0910–3. Izračunajte skupni tlak, potreben za proizvodnjo metanola z 90-odstotnim izkoristkom, če sta CO in H 2 vzeta v razmerju 1:2.
CO (g) + 2H 2 (g) \u003d CH 3 OH (g)
je v ravnovesju pri 500 K in 10 barih. Če so plini idealni, kako bodo na izkoristek metanola vplivali naslednji dejavniki: a) povečanje T; b) napredovanje p; c) dodajanje inertnega plina pri V= konst; d) dodajanje inertnega plina pri p= konst; e) dodajanje H2 at p= konst?
2NOCl (g) \u003d 2NO (g) + Cl 2 (g)
nastavljen na 227 o C in skupni tlak 1,0 bar, ko je parcialni tlak NOCl enak 0,64 bara (sprva je bil prisoten samo NOCl). Izračunaj r G o za reakcijo. Pri kakšnem skupnem tlaku bo parcialni tlak Cl 2 0,10 bara?
N 2 (g) + 3H 2 (g) \u003d 2NH 3 (g)
pri 400 o C je K = 1.60 10 –4 .
PCl 5 (g) = PCl 3 (g) + Cl 2 (g).
Kakšna bo stopnja disociacije PCl 5, če v sistem dodamo N 2, tako da je parcialni tlak dušika 0,9 atm? Skupni tlak se vzdržuje na 1 atm.
N 2 (g) + O 2 (g) \u003d 2NO (g)
Kp = 2,510–3. Ravnotežna zmes N 2 , O 2 , NO in inertnega plina pri skupnem tlaku 1 bar vsebuje 80 % (volumensko) N 2 in 16 % O 2 . Koliko volumskih odstotkov je NO? Kakšen je parcialni tlak inertnega plina?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Študijska vprašanja
Stanje ravnotežja
Ravnotežna konstanta
Izračun ravnotežnih koncentracij
Premik v kemijskem ravnovesju. Le Chatelierjevo načelo
Stanje ravnotežja
Reakcije, ki potekajo pod enakimi pogoji hkrati v nasprotnih smereh, imenujemo reverzibilne..
Razmislite o reverzibilni reakciji, ki poteka v zaprtem sistemu
Hitrost neposredne reakcije je opisana z enačbo:
 pr = k pr [A] [B],
pr = k pr [A] [B],
kje  pr je hitrost neposredne reakcije;
pr je hitrost neposredne reakcije;
k pr konstanta hitrosti neposredne reakcije.
Sčasoma se koncentracije reagentov AMPAK in AT zmanjša hitrost reakcije pade (slika 1, krivulja  itd).
itd).
Reakcija med AMPAK in AT vodi do tvorbe snovi C in D, katerih molekule v trkih lahko spet dajo snovi AMPAK in AT.
Hitrost povratne reakcije je opisana z enačbo:
 arr = k
arr [C] [D],
arr = k
arr [C] [D],
kje  arr je hitrost povratne reakcije;
arr je hitrost povratne reakcije;
k arr konstanta hitrosti povratne reakcije.
Kot koncentracije snovi C in D poveča hitrost povratne reakcije (slika 1, krivulja  arr).
arr).

Slika 1. Sprememba hitrosti naprej in povratnih reakcij v času
Čez čas hitrosti reakcije naprej in nazaj postaneta enaki:
 pr =
pr =  prir
prir
To stanje sistema se imenuje stanje ravnotežja .
V stanju ravnovesja se koncentracije vseh njegovih udeležencev s časom prenehajo spreminjati . Takšne koncentracije imenujemo uravnoteženo .
Kemijsko ravnovesje – to je dinamično ravnotežje. Nespremenljivost koncentracij snovi v zaprtem sistemu je posledica nenehno potekajočih kemičnih procesov. Hitrosti neposredne in povratne reakcije nista enaki nič, opazovana hitrost procesa pa je enaka nič.
Enakost hitrosti prednjih in povratnih reakcij je kinetični pogoj kemijskega ravnovesja.
2. Konstanta ravnotežja
Ko sta hitrosti prednje in povratne reakcije enaki
 pr =
pr =  prir
prir
poštena enakost
k pr [A] [B] = k arr [C] [D],
kje [ A], [B], [OD], [D] so ravnotežne koncentracije snovi.
Ker konstante hitrosti niso odvisne od koncentracij, lahko enačbo zapišemo drugače:

Razmerje konstant hitrosti neposredne in povratne reakcije ( k itd / k prir ) imenujemo konstanta kemijskega ravnovesja:
|
|
Resnično kemijsko ravnovesje je mogoče vzpostaviti le, če so vse osnovne stopnje reakcijskega mehanizma v ravnovesju. Ne glede na to, kako zapleteni so mehanizmi neposredne in povratne reakcije, morajo v stanju ravnovesja zagotoviti stehiometrični prehod izhodnih snovi v reakcijske produkte in nazaj. To pomeni, da je algebraična vsota vseh stopenj procesa enaka stehiometrični reakcijski enačbi, tj. stehiometrični koeficienti so vsota molekularnosti vseh stopenj mehanizma.
Za kompleksno reakcijo
aA + bB cC + dD
|
K c = |
Za isto temperaturo je razmerje med produktom ravnotežnih koncentracij reakcijskih produktov po potencah, enakih stehiometričnim koeficientom, in zmnožku ravnotežnih koncentracij izhodnih snovi po potencah, enakih stehiometričnim koeficientom, konstantna vrednost.
To je druga formulacija zakona množičnega delovanja.
Izraz za ravnotežno konstanto heterogene reakcije vključuje le koncentracije snovi v tekoči ali plinasti fazi, saj koncentracije trdnih snovi praviloma ostajajo konstantne.
Na primer, izraz za konstanto ravnovesja naslednje reakcije
CO 2 (g) + C (tv) 2CO (g)
je napisano takole:
Za c =  .
.
Enačba konstante ravnotežja kaže, da so v ravnotežnih pogojih koncentracije vseh snovi, ki sodelujejo v reakciji, med seboj povezane. Številčna vrednost konstante ravnotežja določa, kakšno mora biti razmerje koncentracij vseh reaktantov v ravnovesju.
Sprememba koncentracije katere koli od teh snovi povzroči spremembo koncentracije vseh drugih snovi. Posledično se vzpostavijo nove koncentracije, vendar razmerje med njimi spet ustreza ravnotežni konstanti.
Vrednost konstante ravnotežja je odvisna od narava reaktantov in temperatura.
Ravnotežna konstanta, izražena z molskimi koncentracijami reaktantov ( Zaz) in ravnotežna konstanta, izražena z ravnotežnimi parcialnimi tlaki ( ZaR) (glej "Osnove kemijske termodinamike"), so med seboj povezani z razmerji:
ZaR= KzRT , Kc = KR / (RT) ,
kjer je sprememba števila plinastih molov v reakciji.
Standardna sprememba Gibbsove energije je
G T = - RT ln Kstr,
G T = H – T S.
Po izenačitvi desnih delov enačb:
- RT ln Kstr = H – T S
ln K R = - H / ( RT) + S/ R .
Enačba ne določa samo vrste odvisnosti konstante od temperature, ampak tudi kaže, da je konstanta določena z naravo reagirajočih snovi.
Konstanta ravnotežja ni odvisna od koncentracij (kot tudi konstanta hitrosti reakcije), mehanizma reakcije, aktivacijske energije in prisotnosti katalizatorjev. Sprememba mehanizma, na primer ob uvedbi katalizatorja, ne vpliva na številčno vrednost ravnotežne konstante, seveda pa spremeni hitrost doseganja ravnotežnega stanja.
Konstanta kemijskega ravnovesja
Kvantitativna značilnost kemijskega ravnovesja je konstanta ravnovesja , ki se lahko izrazi z ravnotežnimi koncentracijami C i , parcialnimi tlaki P i ali molskimi deleži X i reaktantov. Za neko reakcijo
ustrezne ravnotežne konstante so izražene kot sledi:



Konstanta ravnotežja je značilna količina za vsako reverzibilno kemijsko reakcijo; vrednost konstante ravnotežja je odvisna samo od narave reagirajočih snovi in temperature. Na podlagi enačbe stanja idealnega plina, zapisane kot relacija P i = C i RT, kjer С i = n i /V, in Daltonovega zakona za idealno mešanico plinov, izraženega z enačbo P = ΣP i, lahko izpelji razmerje med parcialnim tlakom P i, molsko koncentracijo C i in molskim deležem X i i-te komponente:
![]()
Od tu dobimo razmerje med K c , K p in K x:
![]()
Tukaj je Δν sprememba števila molov plinastih snovi med reakcijo:
Δν = – ν 1 – ν 2 – ... + ν" 1 + ν" 2 + ...
Vrednost ravnotežne konstante K x je za razliko od ravnotežnih konstant K c in K p odvisna od skupnega tlaka Р.
Izraz za konstanto ravnotežja elementarne reverzibilne reakcije je mogoče izpeljati iz kinetičnih konceptov. Razmislite o procesu vzpostavljanja ravnovesja v sistemu, v katerem so v začetnem trenutku prisotne samo začetne snovi. Hitrost neposredne reakcije V 1 je v tem trenutku največja, hitrost povratne reakcije V 2 pa nič:
![]()
![]()
Z zniževanjem koncentracije izhodnih snovi se povečuje koncentracija reakcijskih produktov; v skladu s tem se hitrost reakcije naprej zmanjša, hitrost povratne reakcije se poveča. Očitno je, da se bosta po določenem času hitrosti neposredne in povratne reakcije izenačili, po tem pa se bodo koncentracije reaktantov prenehale spreminjati, tj. se vzpostavi kemično ravnovesje.
Ob predpostavki, da je V 1 \u003d V 2, lahko zapišemo:

Tako je ravnotežna konstanta razmerje med konstantami hitrosti neposredne in povratne reakcije. To pomeni fizični pomen ravnotežne konstante: kaže, kolikokrat je hitrost neposredne reakcije večja od hitrosti povratne pri dani temperaturi in koncentracijah vseh reagirajočih snovi, ki so enake 1 mol / l. Zgornja izpeljava izraza za ravnotežno konstanto pa izhaja iz na splošno napačne predpostavke, da je hitrost kemijske reakcije neposredno sorazmerna s produktom koncentracij reaktantov, vzetih po potencah, ki so enake stehiometričnim koeficientom. Kot je znano, v splošnem primeru eksponenti pri koncentracijah reagentov v kinetični enačbi kemijske reakcije ne sovpadajo s stehiometričnimi koeficienti.
11. Redoks reakcije: definicija, osnovni pojmi, bistvo oksidacije in redukcije, najpomembnejši oksidanti in reducenti reakcije.
Redox se imenuje procesi, ki jih spremlja premik elektronov iz enih prostih ali vezanih atomov na druge. Ker v takšnih primerih ni pomembna stopnja premika, temveč samo število premaknjenih elektronov, je običajno, da je premik pogojno vedno popoln in govorimo o odboju ali premiku elektronov.
Če atom ali ion elementa odda ali sprejme elektrone, potem se v prvem primeru oksidacijsko stanje elementa dvigne in preide v oksidirano obliko (OF), v drugem primeru pa se zmanjša in element preide v reducirano obliko (WF). Obe obliki tvorita konjugiran redoks par. Vsaka redoks reakcija vključuje dva konjugirana para. Ena od njih ustreza prehodu oksidanta, ki sprejema elektrone v svojo reducirano obliko (OF 1 → VF 1), druga pa ustreza prehodu reducenta, ki oddaja elektrone v svojo oksidirano obliko (VF 2 → OF 2). ), na primer:
Cl 2 + 2 I - → 2 Cl - + I 2
OD 1 WF 1 WF 2 OD 2
(tukaj je Cl 2 oksidant, I je redukcijsko sredstvo)
Tako je vedno ista reakcija tako proces oksidacije reducenta kot proces redukcije oksidanta.
Najdemo lahko koeficiente v enačbah redoks reakcij elektronske tehtnice in ravnotežje elektronov. V prvem primeru je število prejetih ali doniranih elektronov določeno z razliko v oksidacijskih stopnjah elementov v začetnem in končnem stanju. primer:
HN 5+ O 3 + H 2 S 2– → N 2+ O + S + H 2 O
Pri tej reakciji oksidacijsko stanje spremenita dva elementa: dušik in žveplo. Enačbe elektronskega ravnotežja:
Delež disociiranih molekul H 2 S je nepomemben, zato v enačbo nadomestimo ne ion S 2–, temveč molekulo H 2 S. Najprej se izravna ravnovesje delcev. Hkrati se v kislem mediju za izravnavo uporabijo vodikovi ioni, dodani oksidirani obliki, in molekule vode, dodane reducirani obliki. Nato se ravnotežje nabojev izenači, koeficienti, ki izenačujejo število danih in prejetih elektronov, pa so prikazani desno od črte. Po tem se spodaj zapiše povzetek enačbe ob upoštevanju koeficientov:
Dobili smo reducirano ionsko-molekularno enačbo. Če mu dodamo ione Na + in K +, dobimo podobno enačbo v polni obliki, pa tudi molekularno enačbo:
NaNO 2 + 2 KMnO 4 + 2 KOH → NaNO 3 + 2 K 2 MnO 4 + H 2 O
V nevtralnem mediju se ravnovesje delcev izenači z dodajanjem molekul vode na levo stran polovičnih reakcij, H + ali OH - ioni pa se dodajo na desno stran:
I 2 + Cl 2 + H 2 O → HIO 3 + HCl
Izhodne snovi niso kisline ali baze, zato je v začetnem obdobju reakcije medij v raztopini blizu nevtralnega. Enačbe polovične reakcije:
| I 2 + 6 H 2 O + 10e → 2 IO 3 – + 12 H + | |
| Cl 2 + 2e → 2 Cl - | |
| I 2 + 5 Cl 2 + 6 H 2 O → 2 IO 3 - + 12 H + + 10 Cl - |
Reakcijska enačba v molekularni obliki:
I 2 + 5 Cl 2 + 6 H 2 O → 2 HIO 3 + 10 HCl.
NAJPOMEMBNEJŠI OKSIDANTI IN REDUCENTI. KLASIFIKACIJA REDOKS REAKCIJ
Meje oksidacije in redukcije elementa so izražene z največjimi in najmanjšimi vrednostmi oksidacijskih stanj *. V teh skrajnih stanjih, določenih s položajem v periodnem sistemu, ima element možnost pokazati samo eno funkcijo - oksidanta ali reducenta. Skladno s tem so snovi, ki vsebujejo elemente v teh oksidacijskih stanjih, samo oksidanti (HNO 3, H 2 SO 4, HClO 4, KMnO 4, K 2 Cr 2 O 7 itd.) ali le reducenti (NH 3, H 2 S, vodikovi halogenidi, Na 2 S 2 O 3 itd.). Snovi, ki vsebujejo elemente v vmesnih oksidacijskih stanjih, so lahko oksidanti in reducenti (HClO, H 2 O 2, H 2 SO 3 itd.).
Redoks reakcije delimo na tri glavne vrste: intermolekularne, intramolekularne in disproporcionacijske reakcije.
Prva vrsta vključuje procese, pri katerih so atomi oksidacijskega in redukcijskega elementa del različnih molekul.
Intramolekularne reakcije imenujemo reakcije, pri katerih sta oksidant in reducent v obliki atomov različnih elementov del iste molekule. Na primer, termična razgradnja kalijevega klorata po enačbi:
2 KClO 3 → 2 KCl + 3 O 2
Reakcije disproporcioniranja so procesi, pri katerih sta oksidacijsko in redukcijsko sredstvo isti element v istem oksidacijskem stanju, ki se med reakcijo tako zmanjšuje kot povečuje, na primer:
3 HClO → HClO 3 + 2 HCl
Možne so tudi povratne disproporcionalne reakcije. Sem spadajo intramolekularni procesi, pri katerih je isti element oksidant in reducent, vendar v obliki atomov, ki so v različnih stopnjah oksidacije in jo kot rezultat reakcije izenačijo npr.
Novi članki
- Češnjeva pita - preprosta in zelo okusna
- Preprosta makova torta brez moke
- Hitra pita z lisičkami
- Krhko pecivo: kako hitro in enostavno kuhati doma
- Krhko pecivo za piškote: recepti s fotografijami
- Solata "Moška kaprica" s piščancem Solata moška kaprica z dimljenim piščancem recept
- Recept za sirove kolačke s krompirjem
- Makova torta brez moke. Kako narediti makovo torto brez moke
- Kuhanje ruskih sirovih pogač s krompirjem
- Tricks Games ugani število od 1 do 10
Priljubljeni članki
- Kako pravilno spati, da boste dovolj spali?
- Znanstveniki: mrtve ljudi je dejansko mogoče oživiti dan po smrti
- Kaj čuti človek, ko vanj udari strela?
- Posledice udara strele v človeka
- Kviz: Kako veš, če si zaljubljen?
- "Ponoči sem šel na stranišče in na hodniku zagledal neznanca"
- O rojstnih kletvicah in kako jih prekiniti
- Kako zgraditi ograjo iz profiliranega lista z lastnimi rokami: navodila po korakih, fotografije, videoposnetki
- Navodila za gradnjo ograje iz valovite plošče z in brez temeljev naredite sami
- Kako pravilno oskrbovati zasebno hišo z vodo iz vodnjaka ali vodnjaka: nasveti mojstrov


